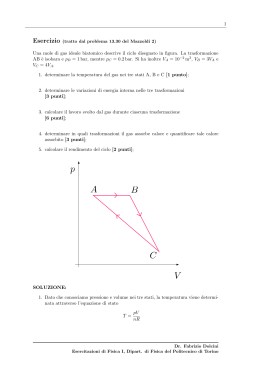
Un gas perfetto biatomico compie il ciclo reversibile ABCA costituito da : un riscaldamento isocoro da A a B , una espansione adiabatica da B a C ed una compressione isobara da C ad A . p B se pA = 2 105 Pa V A = 10 l TA = 350 K A e C TB = 700 K a) determinare il valore della temperatura TC b) verificare numericamente che la variazione di entropia calcolata lungo la trasformazione B→A→C sia uguale a quella che si ha lungo la trasformazione B→C V questo esercizio e’ gia’ stato risolto in precedenza in relazione alla determinazione del lavoro L compiuto dal gas durante il ciclo e del il rendimento h del ciclo risultava L = 520 J pB = 4 105 Pa e h = 10.4% VC = 1.64 102 m3 per determinare la temperatura TC utilizzeremo la relazione di Poisson 1 C C TV dunque 1 B B =T V da cui VA TC = TB VC VB TC = TB VC 1 TC = 574.3 K 1 per quanto riguarda la seconda domanda tutte le trasformazioni termodinamiche la variazione di entropia deve essere nulla in quanto il gas sta effettuando una trasformazione ciclica la trasformazione da B a C e’ adiabatica reversibile quindi SBC = 0 mentre per la trasformazione da B ad A a C si ha S BA S AC dT = ncV B T A TA TC = ncV ln nc p ln TB TA dT A nc p T C 5 per un gas biatomico cV = R ma cP = R cV 2 S BA S AC 7 c p = R quindi 2 5 TA 7 TC = n R ln n R ln 2 TB 2 TA 5 TA 7 TC 5 350 7 574 = nR( ln ln ) = nR( ln ln ) 2 TB 2 TA 2 700 2 350 = nR(1.733 1.733) = 0
Scaricare