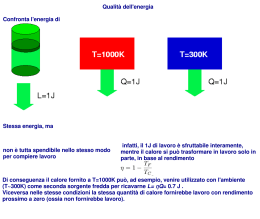
Lezione 10 Termodinamica Argomenti della lezione: • relazione di Mayer • trasformazioni adiabatiche • trasformazioni isoterme • macchine termiche • ciclo di Carnot • secondo principio della termodinamica • cenni sull’entropia Relazione di Mayer Abbiamo ricavato c p cV R Rapporto cp cV Valori sperimentali Gas ideali monoatomici (He, Ar, vapori metallici di Na, Hg) 3 cV R 2 5 cp R 2 5 3 Gas ideali biatomici (H2, N2, NO, CO) 5 cV R 2 7 cp R 2 7 2 Riassunto I gas che considereremo saranno sempre mono o bi atomici U ncV T per qualsiasi trasformazione Q ncV T se V costante Q nc p T se p costante pV nRT equazione dei gas perfetti c p cV R relazione di Mayer U Q W primo principio della termodinamica Trasformazioni adiabatiche generale Se il gas è contenuto in un contenitore con pareti adiabatiche può scambiare con l’esterno solo lavoro WAB U W AB ma U ncV T2 T1 cp c p cV R cV cV 1 p 2V2 p1V1 ncV p 2V 2 p1V1 nR c p cV 1 p 2V2 p1V1 1 Trasformazioni adiabatiche reversibile Se il gas è contenuto in un contenitore con pareti adiabatiche può scambiare con l’esterno solo lavoro dU dW ncV dT pdV 0 nRT ncV dT dV 0 V nRT p V Separando le variabili dT n c p cV ncV dV 0 T V dT c p cV dT dV dV 1 0 T cV V T V Trasformazioni adiabatiche reversibile dV dT 1 V T Integrando fra stati A e B VB VB TA 1ln ln ln VA TB VA VB VA 1 1 TA ln TB TA TB VB 1 TA V A 1 TB Trasformazioni adiabatiche reversibile Considerando l’equazione di stato dei gas perfetti si ottiene T V 1 costante pV costante 1 T p costante Trasformazioni isoterme Considerando l’equazione di stato dei gas perfetti si ottiene Q W U 0 pV costante nel caso di isoterma reversibile W AB B B A A pdV VB nRT dV nRT ln V VA Macchine termiche Una macchina termica è un dispositivo che trasforma calore in lavoro. Contiene una sostanza che, in maniera ciclica, assorbe una quantità di calore Q1, cede una quantità di calore Q2 e compie un lavoro W. Rendimento di una macchina termica: W Q1 Il funzionamento è ciclico, quindi per il 1° principio U Q W 0 Q1 Q2 W 0 U Q W 0 W Q1 Q2 Q1 Q2 Q1 Macchine termiche Schema di una generica macchina termica: W Rendimento: Q1 Schema di una generica macchina frigorifera: Efficienza: Q2 W Ciclo di Carnot p Trasformazione ciclica ABCD A T2 Trasformazione isoterma AB alla temperatura T2. Espansione isoterma B D T1 C V Trasformazione isoterma CD alla temperatura T1. Compressione isoterma Trasformazione adiabatica DA. Compressione adiabatica Trasformazione adiabatica BC. Espansione adiabatica Scopo: W Rendimento: QC Ciclo di Carnot p Nella espansione isoterma AB A U AB 0 T2 pV costante B B W AB D T1 Nella espansione adiabatica BC pdV A C B V QBC 0 QAB WAB A nRT2 VB dV nRT2 ln V VA U BC WBC WBC U BC ncV T ncV T2 T1 Ciclo di Carnot p Nella compressione isoterma CD A U CD 0 T2 pV costante B D WCD D T1 pdV C C D V Nella compressione adiabatica DA QDA 0 QCD WCD C nRT1 VD dV nRT1 ln V VC U DA WDA WDA U DA ncV T ncV T1 T2 Ciclo di Carnot p Riassumendo: A T2 Q AB W AB nRT2 ln VB 0 VA QCD WCD nRT1 ln VD 0 VC B D T1 C V Per cui il lavoro totale è dato da: W W AB WBC WCD WDA nRT2 ln V V nR T2 ln B T1 ln D VA VC U BC U DA WBC WDA VB V WDA nRT1 ln D WDA VA VC Ciclo di Carnot p Ma il rendimento è dato dal rapporto fra lavoro e calore assorbito. In questo caso il lavoro è stato appena calcolato, il calore viene assorbito durante l’espansione isoterma AB A T2 B D T1 C Q AB QCD W Q AB Q AB V VB VD nR T2 ln T1 ln VA VC VB nRT2 ln VA VB VD T2 ln T1 ln VA VC VB T2 ln VA Ciclo di Carnot p Osserviamo che le trasformazioni BC e DA sono di tipo adiabatico, per cui: A T2 T V 1 costante B D T1 C V T2 VB 1 T1 VC 1 T1 VD 1 T2 V A 1 T2 VC T1 VB T2 VD T1 V A 1 1 VC VB 1 VD VA 1 Ciclo di Carnot p A E in definitiva T2 VC VB B D T1 C V VD VA VD VC VA V B V V T2 ln B T1 ln D VA VC VB T2 ln VA VB VA T2 ln T1 ln VA VB T2 T1 T1 1 VB T2 T2 T2 ln VA Secondo principio della termodinamica Può essere espresso in molti modi equivalenti: Non è possibile realizzare una trasformazione il cui unico risultato sia la conversione integrale di calore assorbito in lavoro (enunciato di Kelvin). Non è possibile realizzare una trasformazione il cui unico risultato sia il trasferimento di calore da una sorgente a temperatura più bassa ad una sorgente a temperatura più alta (enunciato di Clausius). Non è possibile realizzare una macchina termica con rendimento = 100%. Non è possibile realizzare una macchina frigorifera che non assorba lavoro. Trasformazioni reversibili e irreversibili Entropia Una trasformazione si dice reversibile se è costituita dalla successione di infiniti stati di equilibrio. In questo caso il sistema può essere riportato allo stato iniziale ripercorrendo all’indietro la stessa trasformazione. In una trasformazione irreversibile il sistema passa per stati di non equilibrio e non può essere invertita perfettamente. Consideriamo una trasformazione reversibile in ciascun elemento della quale una quantità di calore dQrev viene scambiata ad una temperatura T. Si definisce variazione di entropia: f dQrev S T i Entropia e secondo principio In un sistema isolato, in cui ci sono solo trasformazioni reversibili, l’entropia rimane costante ( S=0). In un sistema isolato, in cui ci sono trasformazioni irreversibili, l’entropia aumenta sempre ( S>0). Quindi l’entropia determina il verso delle trasformazioni irreversibili: un sistema evolverà sempre in modo che l’entropia aumenti. Significato probabilistico dell’entropia:; esprime il grado di disordine microscopico di un sistema. Un sistema isolato evolve quindi sempre verso stati più disordinati.
Scaricare