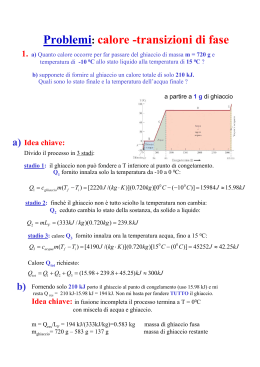
Moli e numero di Avogadro Una mole di una qualunque sostanza contiene un numero di atomi o molecole pari a NA=6,02×1023 (numero di Avogadro) Il peso molare M di una sostanza è pari al peso di una mole della sostanza in esame Massa di un atomo (molecola): m M N A Esempio: per l’alluminio M=26,9815 g/mol in 26,9815g di Al ci sono NA atomi la massa di un atomo di Al è 4,48×10-23g Data una massa Mcam di una sostanza, il numero di moli è: M cam M cam n M mN A Il numero di atomi è invece dato da: N nN A I gas ideali A densità molto basse, i gas reali tendono ad obbedire alla legge dei gas perfetti: pV nRT Nella precedente equazione T è la temperatura assoluta e R=8,31 J/(mol K)=0,082 l·atm/(mol/K) è la costante dei gas Introducendo la costante di Boltzmann k=R/NA=1,38×10-23 J/K, la legge dei gas perfetti diventa: pV NkT Isoterme reversibili per i gas perfetti p Se T è costante, l’equazione pV=nRT rappresenta un ramo di iperbole nel piano pV A B Legge di Boyle: pV=costante V VA VB Lavoro compiuto dal gas nel tratto AB: B B nRT VB B L pdV dV nRT lnV A nRT ln V VA A A Se VB>VA (espansione) è L>0; se VB<VA (compressione) è L<0 Isobare reversibili per i gas perfetti p A Se p è costante, si ha un tratto di retta orizzontale nel piano pV B 1a Legge di Gay-Lussac: V/T=costante V VB VA Lavoro compiuto dal gas nel tratto AB: B B A A L pdV p dV pVB V A pΔV Se VB>VA (espansione) è L>0; se VB<VA (compressione) è L<0 Isocore reversibili per i gas perfetti p Se V è costante, si ha un tratto di retta verticale nel piano pV B 2a Legge di Gay-Lussac: p/T=costante A V Lavoro compiuto dal gas nel tratto AB: B L pdV 0 perchè V A VB A Calori specifici molari dei gas Definizione di calore specifico: Q mcΔ T Esprimendo la massa m in termini del numero di moli n e della massa molare M, si ha: m nM Q ncM Δ T nCΔ T dove si è introdotto il calore specifico molare C=cM Nei solidi e nei liquidi i calori specifici non dipendono dal tipo di trasformazione a cui essi sono soggetti Nei gas invece i calori specifici dipendono dal tipo di trasformazione: CV = calore specifico molare a volume costante CP = calore specifico molare a pressione costante Espansione libera di un gas perfetto Joule osservò sperimentalmente che la temperatura del gas non varia in seguito all’espansione, mentre cambiano sia p che V L=0 perchè nell’espansione non c’è un pistone che si muove Q=0 perchè il gas è termicamente isolato per il primo principio della termodinamica anche ΔEint=0 essendo variati p e V, ma non T, Eint non può dipendere da p e V, ma dipende solo da T: Eint = Eint(T) Energia interna di un gas perfetto (1) p A’ B Consideriamo un gas ideale che passa da uno stato iniziale A(pA,VA,TA) ad uno stato finale B(pB,VB,TB) seguendo il percorso AA’B (AA’ isocora, A’B isoterma) A V Variazione di energia interna: Δ Eint,AB Eint,B Eint,A E int,B Eint,A' Eint,A' Eint,A Δ Eint,A' B Δ Eint,AA' Energia interna di un gas perfetto (2) Nel tratto A’B la variazione di energia interna è nulla perchè lungo A’B la temperatura non cambia ed Eint dipende solo da T: Δ E int,A' B 0 Δ E int,AB Δ E int,AA' Applichiamo la prima legge della termodinamica al tratto AA’ : LAA' 0 perchè AA’ è isocora QAA' nCV TA' TA nCV TB TA Δ E int,AA' Q AA' LAA' nCV TB TA Dalle relazioni precedenti segue dunque che: Δ E int,AB nCV TB TA nCV Δ T Eint nCV T Relazione di Mayer p A Consideriamo una trasformazione isobara AB e calcoliamo i valori di ΔEint , Q e L B Δ Eint nCV TB TA Q nC P TB TA V L pVB VA nRTB TA Δ Eint Q L nTB TA C P R Dal confronto tra le due espressioni di ΔEint: C P CV R Calori specifici dei gas Tipo di gas CV CP γ= CP/CV Monoatomico (es. He, Ne, Ne, Ar ...) (3/2)R (5/2)R 5/3 Biatomico (es. O2, N2 ...) (5/2)R (7/2)R 7/5 Poliatomico (es. CO2, NH4 ...) 3R 4R 4/3 I valori dei calori molari vengono calcolati nell’ambito della teoria cinetica dei gas Nel caso dei gas poliatomici occorre tener conto della struttura molecolare del gas Adiabatiche reversibili di un gas ideale In una adiabatica il calore scambiato è nullo: Q=0 Primo principio della termodinamica in forma differenziale: dQ dL dEint dEint dL Tenendo conto che Eint=nCVT e dL=pdV, si ha che: nCV dT pdV Ricavando la pressione dall’equazione di stato pV=nRT: dV dT R dV nCV dT nRT V T CV V Dalla relazione di Mayer R=CP - CV : C P CV dV dT dV γ 1 T CV V V Equazioni dell’adiabatica reversibile Integrando la precedente equazione differenziale si ha: lnT γ 1lnV cost lnT γ 1lnV cost ln TV γ 1 cost TV γ 1 cost Ricavando la temperatura dall’equazione di stato pV=nRT : TV γ 1 pV γ 1 cost cost pV γ cost V nR Ricavando il volume dall’equazione di stato pV=nRT : γ nRT cost p 1γ T γ cost pV cost p p γ Esistono dunque tre equazioni per le trasformazioni adiabatiche reversibili, tutte equivalenti tra loro. Adiabatiche nel piano pV p A B L’adiabatica passante per un punto A del piano pV ha, nel punto A, una pendenza maggiore (in modulo) rispetto all’isoterma passante per lo stesso punto V Il lavoro da A a B si può calcolare integrando la curva adiabatica da A a B oppure sfruttando il primo principio della termodinamica: Q 0 L ΔEint nCV (TA TB ) Trasformazioni reversibili di un gas perfetto: quadro riassuntivo Trasform. Equazione Q L ΔEint Isocora V=cost p/T=cost nCV(Tf - Ti ) 0 nCV(Tf - Ti ) Isobara p=cost V/T=cost Isoterma T=cost pV=cost Adiabatica pVγ=cost TVγ-1=cost p1-γTγ=cost nCP(Tf - Ti ) p(Vf - Vi ) nRTln(Vf /Vi ) nRTln(Vf /Vi ) 0 -nCV(Tf -Ti ) nCV(Tf - Ti ) 0 nCV(Tf - Ti ) Macchine termiche Macchina termica = dispositivo che scambia calore con l’ambiente e produce lavoro Per produrre lavoro in maniera continuativa, una macchina termica deve operare in maniera ciclica se la macchina termica utilizza un gas perfetto, il lavoro è pari all’area del ciclo nel piano pV Rendimento = rapporto tra lavoro compiuto dalla macchina termica e calore assorbito in un ciclo L η Qass il rendimento di una macchina termica è un numero sempre compreso tra 0 e 1 il rendimento esprime l’efficienza della macchina Ciclo di Carnot Il ciclo di Carnot è costituito da due isoterme reversibili a temperature TA e TB e due adiabatiche reversibili Rendimento del ciclo di Carnot (1) Calori scambiati dalla macchina nelle 4 trasformazioni: Vb Qab Lab nRTA ln 0 Va Qbc 0 Vd Qcd Lcd nRTB ln Vc Qda 0 0 Vb Vc L Qab Qbc Qcd Qda nRTAln nRTB ln Va Vd Qass Vb Qab nRTA ln Va Rendimento del ciclo di Carnot (2) Consideriamo ora le equazioni delle 4 trasformazioni: paVa pbVb pa pb pc pdVaVbγVcVdγ pbVbγ pcVcγ pb pc pd paVbVcγVdVaγ pcVc pdVd pdVdγ paVaγ Vbγ -1Vdγ -1 Vcγ - 1Vaγ - 1 Tenendo conto dei risultati precedenti: Vb L nRTA TB ln Va Qass Vb nRTA ln Va Vb Vc Va Vd TA TB TB η 1 TA TA Secondo principio della termodinamica Il primo principio stabilisce la conservazione dell’energia, ma non pone limiti alle trasformazioni di energia da una forma all’altra Il secondo principio invece stabilisce delle limitazioni precise alle trasformazioni di energia e individua il verso in cui avvengono spontaneamente i processi fisici Esistono due enunciati del secondo principio, tra loro equivalenti: Enunciato di Kelvin-Planck: è impossibile realizzare un processo che abbia come unico risultato la trasformazione in lavoro del calore fornito da una sola sorgente Enunciato di Clausius: è impossibile realizzare un processo che abbia come unico risultato il trasferimento di calore da un corpo ad un altro a temperatura maggiore
Scaricare