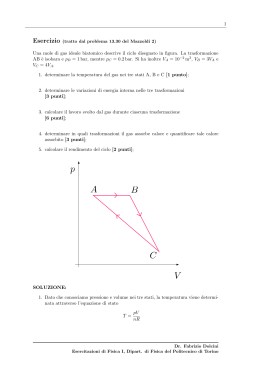
Calore e lavoro La stessa variazione dello stato termodinamico di un sistema, misurata ad esempio dalla variazione della sua temperatura, può essere prodotta sia da un dato lavoro meccanico W (misurato in Joule) compiuto in maniera adiabatica, sia da uno scambio di calore Q avvenuto senza scambio di lavoro (misurato, ad es., in calorie). Si verifica che in tali condizioni il lavoro W ed il calore Q sono proporzionali: se una data variazione dello stato del sistema (ad es., una variazione di temperatura DT1) è prodotta adiabaticamente da un lavoro W1 oppure (senza lavoro meccanico) dallo scambio di calore Q1, ed una diversa variazione dello stato del sistema (ad es., con una variazione di temperatura DT2) è prodotta dal lavoro adiabatico W2 ovvero dallo scambio di calore Q2, risulta sperimentalmente: W2 Q2 W1 Q1 con : ossia: W2 W1 k Q2 Q1 k 4186,8 J / Cal U.Gasparini, Fisica I “equivalente meccanico della caloria” 1 Trasformazioni cicliche Se un sistema termodinamico compie una “trasformazione ciclica” (trasformazione in cui lo stato termodinamico iniziale è uguale a quello finale), scambiando globalmente con i sistemi con i quali interagisce il lavoro W ed il calore Q , il rapporto tra queste due quantità è sempre: W k Q indipendentemente dalla trasformazione ciclica compiuta (ossia dal valore di W ). Esempio: p B un gas si espande C dallo stato A allo stato B e successivamente viene A ricompresso nello stato A, V compiendo globalmente un lavoro W(I) scambiando il calore Q(I) (ciclo I : ABA); nel ciclo II : ACA il gas compie il lavoro W(II) W( II ) W( I ) e scambia il calore Q(II) ; si verifica sempre: k Q( II ) U.Gasparini, Fisica I Q( I ) 2 Relazione tra calore e lavoro scambiati in un ciclo Se si assume la convenzione di misurare il calore con la stessa unità di misura del lavoro (Joule), ponendo: 1Cal 4186,8 J W 1 Q la relazione tra calore e lavoro scambiati in un ciclo diventa: Allora: p (I) B (I ) ( II ) (I ) ( II ) W WAB WBA Q QAB QBA ( II ) ( II ) (I ) (I ) QBA WBA QAB WAB Qualsiasi sia la trasformazione (I), si puo’ sempre considerare un ciclo in cui la trasformazione (II) sia reversibile : ( II ) Q AB ( II ) WAB U.Gasparini, Fisica I ( II ) QBA ( II ) WBA (II) A V p (I) B (II) A ( II ) ( II ) (I ) (I ) QAB WAB QAB WAB V 3 Primo principio della Termodinamica Per una qualsiasi trasformazione termodinamica nella quale vengano scambiati il lavoro W ed il calore Q, la quantità Q - W non dipende dal tipo di trasformazione compiuta, ma unicamente dagli stati termodinamici iniziale e finale del sistema : è possibile allora definire una funzione di stato “energia interna”, tale che la sua variazione tra due stati qualsiasi A e B sia : DU AB U ( B) U ( A) QAB WAB “Primo principio della Termodinamica” Se una trasformazione è reversibile, tale relazione può essere espressa in forma infinitesima ( considerando stati termodinamici infinitamente vicini tra loro, tra i quali si passa con scambi di quantità infinitesime di lavoro dW e calore dQ ): dU dQ dW differenziale della funzione di stato U U.Gasparini, Fisica I quantità infinitesime di calore e lavoro scambiati (non sono differenziali di funzioni) 4 Energia interna del gas ideale L’ esperienza di Joule sull’ “espansione libera” di un gas ideale (e successivamente gli esperimenti di Rossini e Fradsen (1932) effettuati con sensibilità adeguata per misurare la variazione U 0 p in gas reali) mise in evidenza che l’energia interna di un gas ideale è funzione unicamente della temperatura del gas: U = U(T) La variazione di energia interna tra due stati qualsiasi (p0,V0) e (p,V) è: p ( p0 ,V0 ) isoterma A DU AB U ( B) U ( A) U ( B) U (C) U (C) U ( A) 0. C isocora ( p,V ) B DU CB QCB WCB QCB ncV (TB TC ) ncV (TB TA ) 0. DU12 ncV (T2 T1 ) ncV DT U.Gasparini, Fisica I In forma inifinitesima: dU ncV dT 5 V Relazione di Mayer Come conseguenza del 1o Principio e del fatto che, per un gas ideale, DU = n cVDT , si ricava la “relazione di Mayer” tra i calori specifici molari a pressione e volume costante di un gas ideale: c P cV R Infatti, dal 1o Principio applicato ad una trasformazione isobara: Q DU W ncV DT pDV nc p DT (definizione di calore specifico molare a pressione costante) nRDT (dall’equazione di stato: pV nRT differenziando per una isobara (p costante): D( pV ) pDV nRDT ) nc p DT ncV DT nRDT e quindi: U.Gasparini, Fisica I c p cV R 6 Energia cinetica media delle molecole Dal modello cinetico del comportamento (a livello microscopico, ossia molecolare) del gas ideale, si ricava che per una gas in equilibrio termodinamico alla temperatura T, l’energia cinetica media di ogni singola molecola è: per un gas monoatomico: per un gas biatomico: E k E k 3 kT 2 5 kT 2 Tali relazioni sono casi particolari del “principio di equipartizione dell’energia” (dimostrabile nell’ambito della “Meccanica Statistica” sotto condizioni molto generali): ad ogni termine quadratico dell’espressione dell’energia di una singola molecola di un sistema termodinamico corrisponde, all’equilibrio termodinamico del sistema alla temperatura T, un contributo al valor medio dell’energia delle molecole pari a 1 kT 2 con k =R / NA=1,38 1023 J/K “costante di Boltzmann” Per un gas monoatomico (di molecole non interagenti) , l’energia è espressa da 3 termini quadratici (corrispondenti ai 3 gradi di libertà traslazionali della molecola): E Ek 1 1 1 mv x2 mv 2 mv z2 y 2 2 2 Per un gas biatomico, si hanno 5 termini quadratici (3 associati ai gradi libertà traslazionali e 2 a quelli rotazionali della molecola) U.Gasparini, Fisica I 7 Modello cinetico del gas ideale ed energia interna Dal modello cinetico di un gas ideale, l’energia interna è espressa come la somma delle energie cinetiche delle N molecole che costituiscono il gas (essendo nulle le Forze di interazione intermolecolari e quindi non essendovi alcuna energia potenziale di interazione): per un gas monoatomico: energia cinetica media delle singole molecole U N E k N 3 3 R 3 kT nN A T nRT 2 2 NA 2 numero di molecole del gas dU D’altra parte, vale la relazione termodinamica: Confrontando le due espressioni: cV In definitiva, per un gas ideale monoatomico: cV 3 R 2 3 R 2 c p cV R 5 R 2 3 nRdT 2 dU ncV dT cp cV 5 1,67 3 Analogamente, per un gas biatomico: cV U.Gasparini, Fisica I 5 R 2 c p cV R 7 R 2 7 1,4 5 8 Trasformazione adiabatica reversibile di un gas ideale L’ equazione di una trasformazione adiabatica reversibile di un gas ideale è anch’essa ricavabile dal 1o Principio: trattandosi di una trasformazione reversibile, si può utilizzare l’espressione del 1o principio in forma differenziale: dU dW dQ 0 ncV dT pdV 0 posto: cp cV nRT V dT RdV dV (c p cV ) T V V cV Ti ln Tf dT dV ( 1) T V 1 1 TV T V i i f f ( 1) ln Vf Vi Vf ln Vi 1 T V-1 = costante Utilizzando l’eq.di stato del gas ideale (T = pV/nR) : p V = costante o anche ( V= nRT/p) : p1- T =costante U.Gasparini, Fisica I Tp (1-) / = costante p isoterma pV adiab.rev. pV costante cost. 9 V Lavoro in una trasformazione adiabatica reversibile Per una trasf.adiab.rev. di un gas ideale : Vf W Vf p(V )dV Vi piVi V Vi p Vf piVi V dV piVi Vi piVi 1 V 1 f Vi1 i dV V 1 1 ) 1 1 p adiab.rev. pV f Vf Vi Vi f costante 1 Vf Vf Vf piVi Vi1 V ) piVi p f V f 1 1 W( ad .rev . g .id .) Alternativamente, dal 1o Principio: W Q DU ncV (T f 0.= W cV R U.Gasparini, Fisica I pV i i pf Vf essendo: p f V f piVi ) pf Vf piVi Ti ) ncV nR nR ) 1 1 p V i i pf Vf ) cV cV 1 1 R c p cV c p / cV 1 1 10 Gradiente di temperatura dell’atmosfera Esempio: espansione adiabatica di una colonna d’aria ascendente ( si trascurano gli scambi termici con l’atmosfera circostante, data la bassa conducibiltà termica dell’aria) T p (1-) / = costante 1 k d Tp k p k dT Tkp k 1dp 0 con ) dp dT p 1 T dT dp k T p D’altra parte, dalle legge di Stevino: ( infatti: pV nRT peso molare dell’aria dp( z) M ( z) g p( z) g dz RT massa d’aria nel volume V m V M RT M RT p M In definitiva: Confrontando le due espressioni: dT ( z ) ( 1) Mg dz R U.Gasparini, Fisica I RT Mp RT = ) dp( z ) M gdz p RT dT ( z ) M gdz 1 T RT Per l’ aria (miscela di gas biatomici): c p / cV 7 / 5 1,4 M 28,9 103 Kg dT ( z) 9,7 10 3 K / m 9,7 K / Km dz 11
Scaricare