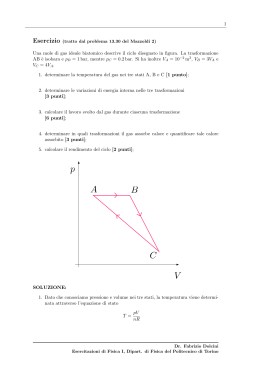
TEORIA CINETICA DEI GAS Gas perfetto •N molto grande •Traiettorie classiche •Interazione da sfere rigide, urti elastici •Casualita’ vx v ∑ = jx N vx = v y = vz = 0 v 2 = x = 2 v ∑ j N ∑ xj N v =0 v 2j = v 2jx + v 2jy + v 2jz 1 = l 2 P ( x; x + Δx) = v 2 = 3 vx2 Δx l PRESSIONE Δp jx = p jxf − p ijx = m(−v jx ) − m(v jx ) = −2mv jx J 'jx (dalla parete) = Δp jx = −2mv jx = − J jx 1 v jx Δt P= 2 l J = FΔt 1 v jx Δt mv 2 Δt jx J jx = 2mv jx 2 = l l Fx p= = ll m∑ v 2jx l3 pV = m∑ v Jx = 2 jx mΔt v 2jx ∑ l ∑v 2 jx = Fx = Jx m = ∑ v 2jx Δt l N v2 3 pV = Nm v 2 3 TEMPERATURA Gas monoatomico → 1 2 U = ∑ mv j 2 1 2 ∑ 2 mv j 1 ∑ v 2j 1 2 K = = m = m v N N 2 2 pV = Nm v 2 3 3 U = nRT 2 2⎛1 ⎞ = ⎜ Nm v 2 ⎟ 3⎝ 2 ⎠ U= 1 Nm v 2 2 2 pV = U 3 pV = nRT L’energia di un gas perfetto e’ proporzionale alla temperatura (scala Kelvin) TEMPERATURA N n= NA 3N RT 3R U 2N A K = = = T 2N A N N R k= = 1.38 × 10−23 J / K NA Velocita’ quadratica media 3 1 K = kT = m v 2 2 2 Costante di Boltzmann vqm = vqm v2 3kT = m 3 K = kT 2 EQUIPARTIZIONE DELL’ENERGIA 3 K = kT 2 v 2j = v 2jx + v 2jy + v 2jz 1 1 1 1 2 2 2 m vx = m v y = m vz = kT 2 2 2 2 Principio di equipartizione dell’energia v 2 = 3 vx2 3 gradi di liberta’ traslazionali ⎛1 ⎞ E = η ⎜ kT ⎟ ⎝2 ⎠ η = nr. di gradi di liberta' EQUIPARTIZIONE DELL’ENERGIA Gas biatomico ⎛1 ⎞ E = 5 ⎜ kT ⎟ ⎝2 ⎠ 1 V= kel x 2 2 Oscillatore armonico ⎛1 ⎞ E = 7 ⎜ kT ⎟ ⎝2 ⎠ Non attivi a temperatura ambiente CAPACITÀ TERMICHE DEI GAS IDEALI CAPACITÀ TERMICA MOLARE A VOLUME COSTANTE Se il sistema scambia con l’ambiente energia sotto forma di calore, tutta l’energia si trasforma in energia interna del gas (energia cinetica), infatti V è costante perciò non può essere compiuto lavoro esterno Q = ΔU Q ΔU CV = = nΔT nΔT 1 dU CV = n dT Gas monoatomico 3 CV = R = 12.5 J/mole K 2 Gas biatomico 5 CV = R = 20.8 J/mole K 2 Gas poliatomico CV = 3R = 24.1 J/mole K CAPACITÀ TERMICA MOLARE A PRESSIONE COSTANTE Una trasformazione a pressione costante è rappresentata nel piano di Clapeyron dal tratto orizzontale (i-f)2 : in questa trasformazione la temperatura varia da T a T+ΔT Si considerano allora le due isoterme alle temperature T e T+ΔT. Poiché tutti i punti di una isoterma corrispondono a stati che hanno la stessa energia interna, in ogni trasformazione (1, 2, 3 …) che collega le due isoterme si ha la stessa variazione di energia interna. Questo vale in particolare per la trasformazione (i-f)1, a volume costante Mentre nella trasformazione 1 la variazione di energia interna è dovuta solamente al calore scambiato, nella trasformazione 2 è in parte dovuta a lavoro esterno, che vale L = pΔV perciò: Q2 = nC p ΔT Q1 = ΔU = nCV ΔT tenendo conto del I principio della termodinamica e dell’equazione di stato dei gas perfetti: ΔU = Q1 = Q2 − pΔV nCV ΔT = nC p ΔT − pΔV = nC p ΔT − nRΔT C p = CV + R Gas monoatomico Gas biatomico Gas poliatomico Relazione di Meyer 5 C p = R = 20.8 J/mole K 2 7 C p = R = 29.1 J/mole K 2 C p = 4 R = 33.3 J/mole K Oscillazione Effetti quantistici (H2) Rotazione Traslazione E’ utile definire il rapporto fra le capacità termiche molari Gas monoatomico Gas biatomico Gas poliatomico γ= Cp CV = 5 = 1.67 3 7 γ = = 1.40 5 4 γ = = 1.33 3 γ= cp cV CAPACITÀ TERMICHE DEI SOLIDI (1) Nel 1819 Doulong e Petit notarono che le CAPACITA’ TERMICHE MOLARI A VOLUME COSTANTE dei solidi sono circa uguali a 25 J/mole K: la quantità di calore per atomo necessaria per variare la temperatura di un solido di una data quantità è circa la stessa per tutti i solidi (2) La CAPACITA’ TERMICA MOLARE A VOLUME COSTANTE di un solido dipende dalla temperatura: tende a 0 per TJ0 e a 25 J/mole K per temperature sufficientemente elevate (al di sopra di un determinata temperatura, detta temperatura di Debye, che dipende dalla sostanza). La meccanica statistica spiega completamente questo comportamento tenendo conto della capacità degli atomi di vibrare nel solido. ⎛1 ⎞ U = N 6 ⎜ KT ⎟ =3nRT ⎝2 ⎠ 1 d cv = ( 3nRT ) = 3R n dT IL I PRINCIPIO DELLA TERMODINAMICA NELLE TRASFORMAZIONI REVERSIBILI Processi adiabatici Il sistema è isolato, perciò Q=0 dU = −δ L pdV = δ L = −dU = − nCV dT dU = nCV dT d ( pV ) = d (nRT ) Vdp + pdV = nRdT Vdp = + nCV dT + nRdT = nC p dT (dalla relazione di Meyer) nC p dT Cp Vdp = =− = −γ pdV − nCV dT CV dp dV = −γ p V integrando termine a termine: pB VB pB VB ln = −γ ln pA VA dp dV ∫p p = −γ V∫ V A A p AVAγ = pBVBγ Si ottiene così la relazione fra pressione e volume nel caso di un processo adiabatico γ pV = costante adiabatica isoterma Da cui: ( pV )V γ −1 = costante TV γ −1 = costante DISTRIBUZIONE DELLE VELOCITA’ f (v) Funzione di distribuzione ΔN = f (v)Δv dN = f (v) dv ∞ N = ∫ f (v) dv 0 ⎛ 1 2⎞ − mv ⎟ ⎜ f (v) = Av 2 exp ⎜ 2 ⎟ ⎜ kT ⎟ ⎝ ⎠ Maxwell ⎛ m ⎞ A = 4π N ⎜ ⎟ 2 π kT ⎝ ⎠ 3 2 DISTRIBUZIONE DELLE VELOCITA’ vqm = v 2 3kT = m ∞ v = ∫ vf (v)dv 0 N ∞ v 8kT = πm 2 = 2 v ∫ f (v)dv 0 N 3kT = m 2kT vP = m
Scaricare