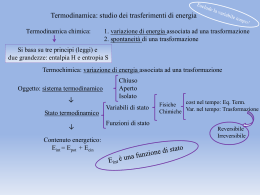
Termodinamica • le leggi più generali sulle trasformazioni (comprese le reazioni) • 1° principio: conservazione dell'energia • 2° principio: aumento del disordine (entropia) 1° principio della termodinamica • L'energia interna U rimane costante • U può variare per – lavoro sul sistema w – calore trasferito al sistema q ΔU = q + w ΔUtot = ΔU + ΔUamb = 0 Funzioni di stato • L'energia interna U è funzione di stato • dipende dallo stato del sistema, non da come questo è stato raggiunto • Altre funzioni di stato: – P pressione – V volume – T temperatura – S entropia (misura del disordine) • q e w non sono funzioni di stato Calore e Energia interna • se non c'è lavoro • se c'è lavoro • se c'è aumento di V a P costante q = ΔU q = ΔU - w w = - P ΔV q = ΔU + P ΔV = = ΔH • Entalpia H = U + PV è funzione di stato Entalpia di reazione CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ΔH = - 890 kJ ΔH dipende dallo stato di reag. e prod. CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) ΔH = - 802 kJ Entalpia standard di reazione ΔH0 ΔH = ΔH0 se tutti i reagenti e prodotti sono nel loro stato standard Legge di Hess • Se una reazione è la somma di altre, la sua entalpia di reazione è la somma dei ΔH delle altre C(gr) + ½ O2(g) → CO(g) ΔH0 = - 110,5 kJ CO(g) + ½ O2(g) → CO2(g) ΔH0 = - 283,0 kJ —————————————————————————————————————— C(gr) + O2(g) → CO2(g) ΔH0 = - 393,5 kJ H2 + I2 H2 2H ΔH = + 436 kJ/mol I2 2I ΔH = + 243 kJ/mol 2H+2I 2 HI ΔH = - (431 x 2) kJ/mol H2 + I2 2 HI ΔH = - 183 kJ/mol 2 HI Legge di Hess Entalpia standard di formazione • L'entalpia standard di formazione ΔH0f di una sostanza è l'entalpia della reazione di formazione della sostanza dagli elementi • Conoscendo le entalpie di formazione si può calcolare l'entalpia di qualsiasi reazione come differenza fra l'entalpia dei prodotti e quella dei reagenti Entropia • L'entropia S è una funzione di stato • misura il disordine di un sistema • Definizione: dqrev dS T • e se T è costante qrev S T 2° principio della termodinamica • In ogni trasformazione l'entropia totale aumenta ΔStot = ΔS + ΔSamb > 0 • Se l'entropia è massima il sistema è in equilibrio L’ entropia S è una misura del grado di disordine molecolare anche S è una funzione di stato I processi spontanei avvengono con un aumento di entropia ΔS > 0 ΔS < 0 L’entropia del sistema può diminuire solo se l’entropia dell’ambiente aumenta in misura superiore. ( II Legge della Termodinamica ) S Se T e P sono costanti • Energia libera di Gibbs G = H - TS • consideriamo reazioni a T e P costanti ΔSamb = - q / T = - ΔH / T S tot S ΔG = ΔH - T ΔS ΔG = - T ΔStot H T • In ogni trasformazione a T e P costanti ΔG < 0 • all'equilibrio ΔG = 0 L’ energia libera G è una funzione di stato che combina l’ entalpia e l’ entropia del sistema G = H – TS a T costante : ΔG = ΔH - T ΔS La variazione di energia libera è una misura della spontaneità di una trasformazione ΔG < 0 processo spontaneo ΔG > 0 processo non spontaneo ΔH > 0 , ΔS < 0 ΔG > 0 ΔH < 0 , ΔS > 0 ΔG < 0 T ΔS > ΔH T ΔS < ΔH ΔG < 0 ΔG > 0 T ΔS > ΔH ΔH < 0 , ΔS < 0 T ΔS < ΔH ΔG > 0 ΔH > 0 , ΔS > 0 ΔG < 0 Accoppiamento di reazioni • ΔG < 0 reazione spontanea • ΔG > 0 reazione non spontanea • Una reazione non spontanea può avvenire se la si accoppia con una reazione spontanea e ΔGtot < 0 • Nella fotosintesi clorofilliana la formazione di glucosio (ΔG > 0) è resa possibile dalla reazione fotochimica Equilibrio chimico aA+bB⇆cC+dD ΔG = c Gm(C) + d Gm(D) - a Gm(A) - b Gm(B) ΔGm(J) = ΔG0m(J) + RT ln aJ ΔG = c ΔG0m(C) + d ΔG0m(D) - a ΔG0m(A) - b ΔG0m(B) + c RT ln aC + d RT ln aD - a RT ln aA - b RT ln aB = = ΔG0 + RT (c ln aC + d ln ad - a ln aA - b ln aB) segue Equilibrio chimico c d a 0 0 C aD G G RT ln G RT ln Q • a b a A aB • all'equilibrio ΔG = 0 c d a 0 C aD G RT ln a b costante a A aB quindi aCc aDd costante a b a A aB ΔG0 = - RT ln K • con l'energia libera si ricava la legge di azione di massa e il valore di K
Scaricare