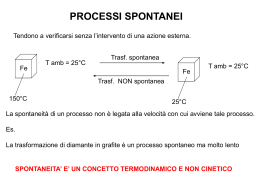
La prima legge della termodinamica definisce un principio di conservazione dell’energia (sistema + ambiente), ma non fornisce nessuna informazione sulla direzione che spontaneamente i processi prendono. Energia termica Energia termica T < 0°C H2O (s) H2O (l) DH< 0 calore Processo esotermico spontaneo T > 0°C X calore Processo comunque esotermico ma non spontaneo NB. Il DH del processo è praticamente 0 ENTROPIA S = k log W Costante di Boltzman Substati del sistema ovvero numero di modi in cui è possibile disporre atomi o molecole in un dato stato tenendo conto dell’energia totale Ludwig Boltzmann ENTROPIA: misura della dispersione della materia ovvero del DISORDINE B A Possibili substati probabilistici B A B A A B P = 1/4 A B D B CA D B CA P = 1/16 B C D D CA B D A D C D B C A B D A B CA D B C CA B A A B C B C C A DA B B A D B C D BA C D A B D C D DA C D B C A Oltre alle variazioni di temperatura di un sistema occorre considerare la variazione dello stato di disordine di un sistema (ENTROPIA : S) Secondo principio della termodinamica La variazione totale di un processo spontaneo deve sempre essere positiva ENTROPIA: misura della dispersione della energia termica + 2 unità di energia 1 1 0 2 2 0 sistema ambiente 3 substati termici ENTROPIA: misura della dispersione della energia termica 10 substati termici Nelle reazioni esotermiche l’energia si distribusce in modo più disordinato rispetto alla condizione iniziale A S A = qA T +q B S B = qB T DSsistema = SSprodotti - SSregenti ambiente A +q B DSambiente = qambiente/T = -DHsistema/T Quando una reazione è esotermica l’entropia dell’ambiente aumenta Quando una reazione è endotermica l’entropia dell’ambiente diminuisce Energia libera di Gibbs DStotale = DSambiente + DSsistema DStot = -DHsist + DSsist T moltiplicando per -T -TDStot = DHsist - TDSsist -TDStot = variazione dell’energia libera di Gibbs del sistema (DGsist) DG = DH - TDS DG = DH - TDS Variazione dell’energia libera DG < 0 DG = 0 DG > 0 Processo spontaneo Sistema all’equilibrio Processo non spontaneo Condizioni che determinano la spontaneità di una trasformazione Reazione spontanea Variazione di entropia Reazione spontanea Esotermica (DH < 0) Aumento (DS > 0) SI In ogni caso DG < 0 Esotermica (DH < 0) diminuizione (DS < 0) SI Solo se |TDS| < |DH| Endotermica (DH > 0) Aumento (DS > 0) SI Solo se |TDS| > |DH| Endotermica (DH > 0) diminuizione (DS < 0) NO In ogni caso DG > 0 Fermentazione del glucosio ad etanolo C6H12O2(s) 2 C2H5OH(l) + 2 CO2(g) DH = - 82 -TDS = - 136 DG = - 218 Combustione dell’etanolo -TDS = + 82 C2H5OH(l) + 3O2(g) 2 CO2(g) + 3 H2O(l) DH = - 1376 Decomposizione del pentossido d’azoto N2O5(s) 2 NO2(g) + 1/2 O2(g) DG = - 1326 DH = + 110 DG = - 30 -TDS = - 140 TERMODINAMICA DELLA TRANSIZIONE DI STATO GHIACCIO ACQUA - 10 °C + 10 °C 0 °C TDH DH DG > 0 DG = 0 GHIACCIO DG = + 213 J/mole GHIACCIO ACQUA ACQUA DG < 0 DG = - 225 J/mole GHIACCIO ACQUA L’entropia aumenta quando sostanze polari si sciolgono in solventi polari NaCl (s) Na+nH2O + Cl-nH2O DH > 0 DG < 0 -TDS < 0 L’entropia aumenta quando sostanze non polari non si sciolgono in solventi polari DH > 0 DG < 0 -TDS < 0 Evoluzione spontanea di una miscela di fosfolipidi verso la formazione di micelle L’entropia dell’universo è destinata ad aumentare TEOREMA DI GINSBERG 1. Non puoi vincere 2. Non puoi pareggiare 3. Non puoi nemmeno abbandonare Seconda legge di Everitt sulla termodinamica La confusione nella società è sempre in aumento. Solo l’enorme sforzo di qualcuno o di qualcosa può limitare tale confusione in un’area circoscritta. Tuttavia, questo sforzo porterà a un aumento della confusione totale della società. Chiosa di Freeman al teorema di Ginsberg tutte le più importanti filosofie che cercano di dare un significato alla vita sono basate sulla negazione di una parte del teorema di Ginsberg. Per esempio: 1. il capitalismo è basato sul presupposto che si possa vincere 2. il socialismo è basato sul presupposto che si possa pareggiare 3. il misticismo è basato sul presupposto che si possa abbandonare tratto da “la legge di murphy” di Arthur Bloch Il paradosso del diavoletto di Maxwell DS < 0 ?
Scaricare