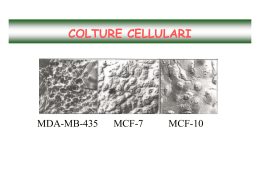
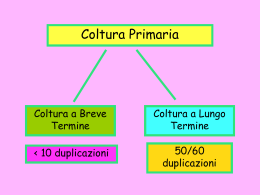
http://dipbsf.uninsubria.it/labfarmaco/ USO delle COLTURE CELLULARI 1. Vantaggi e svantaggi USO delle COLTURE CELLULARI 1. Vantaggi e svantaggi 2. Inizio di una coltura cellulare USO delle COLTURE CELLULARI 1. Vantaggi e svantaggi 2. Inizio di una coltura cellulare 3. Struttura del laboratorio 4. Asepsi CAPPE A FLUSSO LAMINARE BIOHAZARD CABINET a. b. Classe II Classe III CAMERA CALDA USO delle COLTURE CELLULARI 1. Vantaggi e svantaggi 2. Inizio di una coltura cellulare 3. Struttura del laboratorio 4. Asepsi 5. Caratteristiche dell’ambiente esterno substrato fase gassosa pH e temperatura terreni e supplementi 6. Mantenimento di una coltura cellulare sostituzione del terreno subcultura ciclo di crescita CURVA DI CRESCITA di UNA LINEA CELLULARE USO delle COLTURE CELLULARI 1. Vantaggi e svantaggi 2. Inizio di una coltura cellulare 3. Struttura del laboratorio 4. Asepsi 5. Caratteristiche dell’ambiente esterno substrato fase gassosa pH e temperatura terreni e supplementi 6. Mantenimento di una coltura cellulare sostituzione del terreno subcultura ciclo di crescita 7. Conservazione 8. Tipi di contaminazione batteri lieviti muffe micoplasmi contaminazioni crociate 9. Colture tridimensionali COLTURE TRIDIMENSIONALI TECNICHE PER OTTENERLE: 1. Tecnica dell’overlay liquido COLTURE TRIDIMENSIONALI TECNICHE PER OTTENERLE: 1. Tecnica dell’overlay liquido 2. Metodo delle fiasche rotanti COLTURE TRIDIMENSIONALI TECNICHE PER OTTENERLE: 1. Tecnica dell’overlay liquido 2. Metodo delle fiasche rotanti 3. Metodo microwells COLTURE TRIDIMENSIONALI TECNICHE PER OTTENERLE: 1. Tecnica dell’overlay liquido 2. Metodo delle fiasche rotanti 3. Metodo microwells 4. Colture multistrato MISURE DI VITALITA’ IN SISTEMI CELLULARI DI MAMMIFERO TEST 1. PERMEABILITA’ Esclusione/inclusione di coloranti PARAMETRO MISURATO Integrità della membrana cellulare Rilascio di 51Cr e 125I-UDR Rilascio LDH 2. FUNZIONALI Livelli di ATP, ADP e AMP Capacità energetica cellulare Attività della succinato deidrogenasi Funzionalità mitocondriale Sintesi di DNA Capacità di sintesi di macromolecole Sintesi proteica Gradienti ionici e aminoacidici 3. MORFOLOGICI Mantenimento di pH e forza ionica ottimali “Blebbing” della membrana Disorganizzazione della membrana plasmatica Volume Citoscheletro Alterazioni delle proprietà osmotiche cellulari Alterazioni delle strutture cellulari di supporto 4. RIPRODUTTIVI Formazione di colonie in vitro Capacità di divisione cellulare infinita Formazione di colonie in vivo Determinazione della velocità di crescita Aumento del numero di cellule nel tempo MTT ASSAY PROTOCOL 1° giorno: SEMINA delle CELLULE 1. tripsinizzare e contare le cellule; 2. diluire propriamente le cellule in terreno di coltura; 3. pipettare le cellule nei pozzetti (100 ml/pozzetto) usando un pipettatore multicanale (fare attenzione ai volumi pipettati dal pipettatore). Nella colonna 1 e la colonna 12 della piasta vanno pipettati 200 ml di solo terreno e verranno utilizzati come BIANCHI 2° giorno: TRATTAMENTO 4. diluire il farmaco in modo appropriato in terreno di coltura. Fare una diluizione 2x rispetto a quella finale voluta, in quanto 100 ml di diluizione saranno aggiunti ai 100 ml già presenti nel pozzetto; 5. aggiungere solo terreno ai pozzetti di controllo (pozzetti delle colonne 2 e 11); 6. aggiungere il farmaco a partire dalla concentrazione più bassa; 3° giorno: TEST MTT 7. aggiungere 50 ml di MTT (2 mg/ml in PBS) ad ogni pozzetto, inclusi quelli di contr 8. tenere le piastre in incubatore per 3 ore; 9. centrifugare le piatre per 10’ a 2000 rpm; 10. rimuovere il terreno di coltura rovesciando le piastre e asciugandole su un foglio di carta assorbente; 11. aggiungere 120 ml di DMSO ad ogni pozzetto; 12. avvolgere le piastre con alluminio e metterle su un agitatore rotante per 20-30’; 13. leggere le piastre.
Scaricare