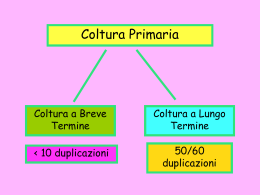
COLTURA DI CELLULE ANIMALI Conoscenze teoriche di base e tecniche operative (1a parte) Dott. Adriano Angelucci [email protected] LTCMA – Aprile 2015 Obiettivi • Attraverso l’applicazione di specifiche procedure e tecnologie si occupa: • Mantenimento in vitro delle migliori sopravvivenza di cellule eucariotiche condizioni di • Permettere la proliferazione delle cellule • Preservare da modifiche contaminazione l’operatore biologiche le cellule e da • Realizzazione di banche per il mantenimento di campioni cellulari Alcune tappe della storia • 1885 Wihelm Roux: prima coltura di tessuto da embrione • • • • • • di pollo 1907 Ross Granville Harrison & Paul Alfred Weiss: sperimentazione su cellule «in vitro» 1912 Alexis Carrel: metodologie asettiche 1920 Prima banca di cellule (ECACC, european collection of cell cultures) 1965 Leonard Hayflick: limite nel numero di divisioni cellulari 1975 Georges Kohler & Cesar Milstein: primo ibridoma per produrre anticorpi 1998 James Thomson & John Gearhart isolano cellule staminali embrionali umane Ross Granville Harrison • Espianti di tubo neurale di embrioni di rana • Coltura in una goccia di linfa di rana contenuta in un vetrino in ambiente sterile • Osservazione «in vitro» dello sviluppo nel tempo di fibre nervose Maggiori conquiste nelle colture cellulari • Uso di antibiotici che inibiscono la crescita dei batteri soluzione di streptomicina (10’000ug/ml) e penicillina (10’000U/ml) • Uso della tripsina per staccare le cellule dalla piastra di coltura senza danneggiarla tripsina (0,25% )+ EDTA (0,2 mg/ml) • Uso di terreni di coltura sintetici Principali aree di studio • Biologia cellulare: sistemi modello per studiare il funzionamento delle cellule • Test di tossicità: valutazione preclinica dei farmaci • Oncologia sperimentale: carcinogenesi, modelli di progressione tumorale • Virologia: ciclo di infezione, produzione di vaccini • Terapia cellulare/genetica: modificazione delle cellule a scopo terapeutico Colture cellulari: pro e contro • PRO • Riduzione dell’uso di animali da sperimentazione • In una linea cellulare le cellule sono omogenee • Possibilità di controllare l’ambiente extracellulare • Saggiare le cellule senza l’interferenza di altre • • • • componenti presenti in vivo CONTRO Le cellule vivono in un ambiente artificiale Comportamento «anomalo» delle cellule rispetto alla situazione in vivo Modello ancora scarsamente predittivo Colture cellulari: conoscenze di base • Caratterizzazione cellulare • Requisiti di laboratorio e strumentazione • Terreni di coltura • Valutazione del rischio e procedure asettiche • Banca cellulare e crioconservazione Caratterizzazione cellulare • Coltura primaria: coltura di cellule prelevate da tessuto (pura o mista) • Linea cellulare: unico tipo cellulare adattato alla vita in coltura (monoclonale) • Linea cellulare continua (stabile): coltura in grado di sopravvivere oltre il limite di Hayflick • Trasformata (immortalizzate) • Tumorale • Ibridoma: fusione di due tipi cellulari caratterizzazione Preparazione di una coltura primaria caratterizzazione Morfologia • Le cellule in coltura possono crescere adese o in sospensione • La morfologia è caratteristica del tessuto di origine caratterizzazione Morfologia • La morfologia è indicatore dello stato della cellula • Presenza di contaminazioni caratterizzazione Mantenimento dei caratteri biologici originari • Lo sperimentatore per offrire significato scientifico ai propri risultati deve assicurare che: • Il tipo cellulare usato corrisponda agli standard depositati nelle banche cellulari • Non sia in alcun modo contaminato • Non abbia subito modificazioni biologiche a seguito delle condizioni di coltura caratterizzazione Colture di cellule adese • la densità cellulare deve essere mantenuta all’interno di valori limite per: • Mantenere costante il tasso di crescita • Evitare la selezione di nuovi cloni • La crescita viene valutata come grado di confluenza caratterizzazione Inibizione da contatto • Cellule normali quando vengono a contatto interrompono la loro proliferazione ed entrano in fase G0 • Le cellule trasformate e tumorali non risentono dell’inibizione da contatto caratterizzazione Grado di confluenza • Quanta superficie di crescita è occupata dalle cellule • Quando le cellule coprono l’80% della superficie vanno spostate (passate) in un nuovo contenitore • Se lasciate ad un alto grado di confluenza per troppo tempo le cellule cambiano fenotipo e possono diventare più difficili da staccare • • Solitamente la crescita esponenziale si ha con valori di densità compresi tra 104 e 105 cellule per cm2 caratterizzazione Colture di cellule adese Numero di cellule • La linea deve essere mantenuta a crescita esponenziale 2 3 4 5 6 7 Densità cellulare (10x) • Conoscenza della superficie di semina • Cellule seminate ad una confluenza troppo bassa entrano in uno stato di quiescenza e non proliferano caratterizzazione Numero di passaggi • Il numero di volte che la coltura è stata passata («split») in un nuovo recipiente • Va sempre indicato sul contenitore • Si consiglia di usare le cellule non oltre un certo numero di passaggi per evitare le modificazioni fenotipiche indotte dalla coltura prolungata caratterizzazione Valutazione del rischio • Prevenire danni ad individui ed ambiente • Direttive e legislazione europee • Il rischio dipende dal tipo di coltura: • Basso rischio=linee continue non umane e linee umane diploidi ben caratterizzate • Medio rischio=linee poco caratterizzate • Alto rischio=colture primarie, linee con patogeni endogeni, linee infettate • adeguato contenimento e procedure sempre rispettate procedure Regole base: cosa fare • Usare sempre camice e guanti. Protezioni particolari sono necessarie quando si maneggia l’azoto liquido • Pulire tutte le superfici prima di ogni operazione e tra operazioni diverse (o diverso operatore) • Identificare in maniera chiara tutti i contenitori che si usano • Tenere in ordine e mantenere le superfici di lavoro il più possibile sgombre da oggetti • Maneggiare una sola linea cellulare alla volta • Controllare i terreni giornalmente per la presenza di contaminazione o di altre alterazioni • Rispettare le scadenze di pulizia e di controllo di incubatore e cappa biologica procedure Protocollo: sottocoltura di cellule aderenti • Le cellule smettono di crescere quando raggiungono il 100% di confluenza o in seguito ad esaurimento dei fattori nutritivi • Le cellule vanno portate in sospensione • Si utilizzano proteasi, soluzioni di proteasi e agenti alchilanti o metodi meccanici procedure Sottocoltura di cellule adese (1) • Accertarsi della confluenza e dello stato delle cellule • Rimuovere il terreno • Lavare lo strato cellulare con PBS senza Ca2+ e Mg2+ con un volume equivalente a metà volume del terreno usato. Ripetere se le cellule hanno alta capacità adesiva • Aggiungere 1ml di tripsina/EDTA ogni 25cm2 di superficie. Fare in modo che il liquido bagni tutta la superficie • Mettere il contenitore in incubatore per 2-10 minuti procedure Tripsina EDTA • La tripsina è un enzima proteolitico che permette il distacco delle cellule dalla piastra di coltura • La tripsina taglia i legami peptidici • EDTA chela gli ioni calcio nel terreno che inibiscono l’azione della tripsina • La tripsina si autodigerisce a 37°C dopo 20 minuti • Lasciare le cellule in incubazione con la tripsina ne riduce la vitalità procedure Sottocoltura di cellule adese (2) • Osservare le cellule al microscopio per accertarsi che • • • • • • siano in sospensione Agevolare il distacco meccanicamente Diluire le cellule in terreno contenente siero Centrifugare Scartare il surnatante e risospendere le cellule in un appropriato volume di terreno completo Contare le cellule Prelevare il volume contenente il numero di cellule necessario procedure Punti cruciali • Diversi tipi cellulari hanno capacità adesive molto diverse • La presenza di EDTA aiuta il distacco delle cellule • L’eliminazione di siero è fondamentale per aumentare l’efficacia della tripsina • L’esposizione prolungata a tripsina può danneggiare irreversibilmente le cellule • La fase di centrifugazione può essere omessa se si usano elevate quantità di siero • La tripsina danneggia le proteine di superficie procedure Procedura di conta • Centrifugare • Risospendere in un piccolo volume di terreno completo • Prelevare 100 ml di sospensione • Aggiungere un ugual volume di Trypan Blue (0,4%) • Riempire le camere del vetrino (5-10 ml) • Osservare al microscopio ad ingrandimento 20x • Calcolare il numero di cellule secondo le specifiche del vetrino di conta (dimensioni del reticolo) procedure Trypan Blue • Colorazione per esclusione • Le cellule vive non assorbono il colorante • Le cellule morte con membrana rotta assorbono il colorante e si colorano di blu procedure Camere di conta (emocitometri) • Vetrini speciali che presentano una griglia microscopica che serve per contare le cellule procedure Calcolo del numero di cellule • A= media delle cellule vive • B= media delle cellule morte • C= fattore di diluizione • D= fattore di conversione in ml • Concentrazione cellule vive= A*C*D • Concentrazione cellule morte=B*C*D Volume della conta= 0,1x 1 mm2=0,1 mm3 Fattore di conversione= 104 (0,1 mm3=0,1ul= 10-4ml) procedure Punti cruciali • Un’adeguata accuratezza della misura si ottiene contando • • • • • almeno 100 cellule Il Trypan blue è tossico ed è un potenziale carcinogeno Le cellule devono essere ben distinte e uniformemente distribuite Evitare la presenza di bolle e detriti Non riempire eccessivamente la camera Se le cellule sono poche, operare una nuova centrifugazione e risospendere in meno terrreno procedure Calcolo della vitalità cellulare • Colorazione con Trypan Blue • Le cellule vive sono impermeabili al Trypan Blue mentre le cellule morte assorbono il colorante • Mescolare trypan blue con un’aliquota delle cellule da valutare • Conta alla camera di conta per stabile il numero di cellule vive (Nv) e il numero di cellule morte (Nm) • % di vitalità = (Nv X 100)/(Nv+Nm) procedure Adesione cellulare ancoraggio migrazione – “homing” comunicazione - anoikis caratterizzazione Tipologie di migrazione • Chemotassi: movimento guidato da un fattore solubile • Aptotassi: movimento guidato da sostanze presenti nella matrice extracellulare non diffusibili • Chemotropismo: crescita (senza movimento) dei tessuti verso una sostanza attraente caratterizzazione Test di adesione • Valutazione della capacità delle cellule di aderire su un substrato fisiologico (collagene, fibronectina, laminina…) • Cerca di riprodurre le condizioni in vivo • La crescita su matrici biologiche modifica la morfologia e la capacità di crescita delle cellule • La presenza di proteine di matrice può stimolare la migrazione • L’adesione può essere un bersaglio farmacologico per impedire la diffusione del tumore Esperienza di laboratorio • Finalità: • Valutare l’azione di un inibitore di tirosin-chinasi nella capacità adesiva di una linea cellulare su collagene • Materiale di partenza: • Piastre rivestite con collagene (6 pozzetti di piastra multipozzetto) • Piastra di cellule umane adese (vario tipo) trattate e non • Tripsina/EDTA • Tampone fosfato • Albumina bovina sierica • Soluzione di trypan blue • Crystal violetto • Formaldeide
Scaricare