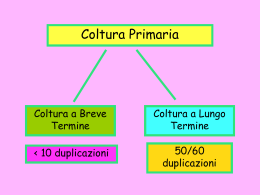
COLTURA DI CELLULE EUCARIOTICHE Conoscenze teoriche di base e tecniche operative Dott. Adriano Angelucci [email protected] LTCMA – Marzo 2014 Colture cellulari: pro e contro • PRO • Riduzione dell’uso di animali da sperimentazione • In una linea cellulare le cellule sono omogenee • Possibilità di controllare l’ambiente extracellulare • Saggiare le cellule senza l’interferenza di altre • • • • componenti presenti in vivo CONTRO Le cellule vivono in un ambiente artificiale Comportamento «anomalo» delle cellule rispetto alla situazione in vivo Modello ancora scarsamente predittivo Obiettivi • Attraverso l’applicazione di specifiche procedure e tecnologie si occupa: • Mantenimento in vitro delle migliori sopravvivenza di cellule eucariotiche condizioni di • Permettere la proliferazione delle cellule • Preservare da modifiche contaminazione l’operatore biologiche le cellule e da • Realizzazione di banche per il mantenimento di campioni cellulari Alcune tappe della storia • 1885 Wihelm Roux: prima coltura di tessuto da embrione • • • • • • di pollo 1907 Ross Granville Harrison & Paul Alfred Weiss: sperimentazione su cellule «in vitro» 1912 Alexis Carrel: metodologie asettiche 1920 Prima banca di cellule (ECACC, european collection of cell cultures) 1965 Leonard Hayflick: limite nel numero di divisioni cellulari 1975 Georges Kohler & Cesar Milstein: primo ibridoma per produrre anticorpi 1998 James Thomson & John Gearhart isolano cellule staminali embrionali umane Ross Granville Harrison • Espianti di tubo neurale di embrioni di rana • Coltura in una goccia di linfa di rana contenuta in un vetrino in ambiente sterile • Osservazione «in vitro» dello sviluppo nel tempo di fibre nervose Maggiori conquiste nelle colture cellulari • Uso di antibiotici che inibiscono la crescita dei batteri soluzione 100x di streptomicina (10’000ug/ml) e penicillina (10’000U/ml) • Uso della tripsina per staccare le cellule dalla piastra di coltura senza danneggiarla tripsina (0,25% )+ EDTA (0,2 mg/ml) • Uso di terreni di coltura sintetici Principali aree di studio • Biologia cellulare: sistemi modello per studiare il funzionamento delle cellule • Test di tossicità: valutazione preclinica dei farmaci • Oncologia sperimentale: carcinogenesi, modelli di progressione tumorale • Virologia: ciclo di infezione, produzione di vaccini • Terapia cellulare/genetica: modificazione delle cellule a scopo terapeutico Colture cellulari: conoscenze di base • Caratterizzazione cellulare • Requisiti di laboratorio e strumentazione • Terreni di coltura • Valutazione del rischio e procedure asettiche • Banca cellulare e crioconservazione Laboratorio • Area isolata e autosufficiente • Doppia area fisica o temporale: quarantena e routine • Linee guida per la disposizione degli strumenti e la sicurezza del personale • Strumentazione minima: • Cappa biologica (Biological Safety cabinet) • Incubatore • Centrifuga • Microscopio a contrasto di fase Cappe biologiche • Si distinguono in base al livello di contenimento in tre classi • Protezione microbiologica (II e III) • Vari gradi di protezione per l’operatore • Filtri HEPA (High Efficiency Particulate Air) Classe I Classe II Classe III Cappe biologiche • Cappa a flusso orizzontale • Protezione microbiologica per le colture • Nessuna protezione per l’operatore • Filtri HEPA in entrata Centrifuga • Separare le cellule dal liquido • 300 g x 5 minuti è l’accelerazione per sedimentare le cellule senza danneggiarle • Raccomandazioni: • Localizzazione • Bilanciamento • Aereosol • Rottura delle provette Centrifuga • Nomogramma e formula di conversione Incubatore • Mantiene le condizioni ambientali ottimali • Temperatura 37°C • Umidità (circa 98%) • pH 7,4 (CO2 sistema tampone bicarbonato) • Pulizia regolare • Controllo dei parametri • Acqua con disinfettante • Solfato di rame • Antimicotici Microscopio a contrasto di fase • Permette di osservare cellule non colorate • Frederick Zernike Premio Nobel Fisica 1953 • Limitazioni: • Alone che circonda le cellule • Bassa risoluzione (obiettivo 40x) • Permette l’osservazione solo di campioni sottili Funzionamento del contrasto di fase • Lo spostamento di fase dell’onda luminosa (non visibile) viene modificato in spostamento di ampiezza dell’onda (visibile) Confronto tra contrasto di fase e ottico Caratterizzazione cellulare • Coltura primaria: coltura di cellule prelevate da tessuto (pura o mista) • Linea cellulare: unico tipo cellulare adattato alla vita in coltura (monoclonale) • Linea cellulare continua (stabile): coltura in grado di sopravvivere oltre il limite di Hayflick • Trasformata (immortalizzate) • Tumorale • Ibridoma: fusione di due tipi cellulari Preparazione di una coltura primaria Ibridoma • TK: • Timidina chinasi • HGPRT: • Ipoxantina-guanina • fosforibosiltransferasi • Terreno HAT • Ipoxantina • Aminopterina • Timidina Selezione tramite terreno HAT Morfologia • Le cellule in coltura possono crescere adese o in sospensione • La morfologia è caratteristica del tessuto di origine Morfologia • La morfologia è indicatore dello stato della cellula • Presenza di contaminazioni Il terreno di coltura • Precisa formulazione dei componenti per soddisfare le diverse esigenze di crescita: • Sali inorganici • Carboidrati • Aminoacidi • Vitamine • Acidi grassi e lipidi • Proteine e peptidi • Siero Terreni di coltura Soluzioni saline bilanciate PBS Hanks BSS DPBS Formano la base dei terreni complessi Terreni base MEM Colture primarie e cellule diploidi DMEM Maggiori livelli di vitamine e aminoacidi supporta un gran numero di tipi cellulari RPMI1640 Inizialmente usato per cellule di leucemia supporta un gran numero di tipi cellulari Iscoves DMEM Favorisce la crescita ad alta densità Leibovitz L-15 Adatto per atmosfera a bassa CO2 Ham F10 Ham F12 Necessitano dell’aggiunta di specifici supplementi (transferrina, insulina, EGF) e contengono HEPES Terreni complessi Terreni senza siero Sistemi tampone • Il mantenimento del pH è importante soprattutto nelle • • • • colture primarie Il pH ottimale è funzione del tipo cellulare (compreso tra 7,0 e 7,7) Tampone “fisiologico” CO2/CO32-/HCO3- in atmosfera al 510% CO2 Tampone HEPES (7,2-7,4) può essere tossico Rosso fenolo come indicatore di pH • Le cellule crescendo possono acidificare il terreno (giallo) • Anche contaminazioni batteriche acidificano il terreno • Terreno viola significa che la CO2 è troppo bassa o le cellule sono morte Siero • Formulazione aspecifica di fattori di crescita • Siero bovino fetale (FBS), siero bovino neonatale (NCS), • • • • • • siero di cavallo (HS) Sostegno alla crescita per molti tipi cellulari Aumenta la capacità tampone Protegge dai danni meccanici Facilita l’adesione Inattivazione del complemento (56°C per 30’) Apporta circa 5 mg di proteine per ml (10% FBS) Problematiche • Rischio per l’operatore • Contaminazione da microorganismi (batteri, funghi, micoplasma) • Contaminazione con altre popolazioni cellulari • Mantenimento dei caratteri biologici di partenza Valutazione del rischio • Prevenire danni ad individui ed ambiente • Direttive e legislazione europee • Il rischio dipende dal tipo di coltura: • Basso rischio=linee continue non umane e linee umane diploidi ben caratterizzate • Medio rischio=linee poco caratterizzate • Alto rischio=colture primarie, linee con patogeni endogeni, linee infettate • adeguato contenimento e procedure sempre rispettate Contaminazione da microorganismi • I principali tipi di contaminanti microbici • Batteri e funghi • Micoplasma • Virus • La contaminazione può avvenire: • Errore dell’operatore • Terreni contaminati • Cappa biologica non funzionante • Incubatore contaminato • Conservazione in azoto liquido contaminato Rilevamento della contaminazione • Modificazione del terreno di coltura: torbidità, abbassamento del pH • Segni di sofferenza cellulare: vacuoli, inclusioni citoplasmatiche, minore adesività • Il micoplasma può essere rilevato tramite coloranti degli acidi nucleici (Hoechst 33258, arancio di acridina) • Il micoplasma può essere individuato tramite test PCR di amplificazione di sequenze specifiche di mRNA Disinfettanti • Principale mezzo per limitare i rischi di contaminazione • Ipoclorito • Disinfettante ad ampio spettro, efficace contro virus • Corrosivo per i metalli, non può essere associato ad altri disinfettanti • Viene rapidamente inattivato in presenza di composti organici • 1000ppm per uso generale e 10000ppm per smaltire terreni • Fenoli • Non attivo su virus • Stabile in presenza di composti organici • Alcoli • Efficaci al 70% (etanolo) e 60-70% (isopropanolo) • Etanolo attivo contro batteri e virus con capside • Isopropanolo non efficace contro virus • Aldeidi (gluteraldeide, formaldeide) • Altamente irritanti • Possono essere usati su superfici metalliche e in forma gassosa Metodi di disinfezione • Lampada UV (germicida) • Sterilizzazione in autoclave • 121°C per almeno 15 minuti • Vanno regolarmente pulite tutte le superfici di: • Cappa biologica • Incubatore (alta frequenza) • Piano del microscopio • Si devono smaltire con attenzione: • Terreni di coltura (ipoclorito per alcune ore) • Consumabile a contatto con le colture (eliminato nei rifiuti appositi) Contaminazione con altri tipi cellulari • Più frequente di quanto si immagini • Avviene quando si lavora contemporaneamente con più linee • Si ha inizialmente una popolazione mista e in seguito solitamente un tipo cellulare prevale • Manipolare un solo tipo cellulare alla volta • Mantenere una banca cellulare Contaminazione batterica e fungina • Contaminazione ad alta velocità • Ben evidente ad occhio nudo: • Intorbidimento del terreno • Il terreno vira verso il giallo • Le cellule si staccano dal substrato di crescita • Batteri e funghi sono ben visibili al microscopio a contrasto di fase • L’addizione di antibiotici e anti-fungini nel terreno di coltura offre una protezione generica • Una contaminazione può essere bloccata in fase iniziale con gli appropriati antibiotici • Si preferisce eliminare prima possibile la coltura contaminata Contaminazione virale • Non sempre porta alla morte delle cellule • Virus non visibili al microscopio a contrasto di fase • Può causare rallentamento nella crescita • Modifica i caratteri biologici della cellula • Non può essere eradicata Contaminazione da micoplasma • E’ il più piccolo procariota conosciuto (0,35mm) • E’ un parassita obbligato che risiede nel citoplasma delle cellule eucariotiche • Non possiede una parete • 5 sono le specie che contaminano normalmente le cellule in coltura • Le conseguenze sul metabolismo cellulare sono evidenti solo in tempi lunghi: • Riduzione del tasso proliferativo • Cambiamento della morfologia • Aberrazioni cromosomiche • Alterazione del metabolismo degli aminoacidi e degli acidi nucleici Contaminazione da micoplasma • Dato che le alterazioni sono sottili e i metodi di rivelazione complessi la contaminazione da micoplasma è molto diffusa (25%) • Viene rivelata tramite test specifici che devono essere effettuati periodicamente: • Colorazione del DNA nel citoplasma • Crescita in agar • Amplificazione delle sequenze in PCR • Test Elisa Mantenimento dei caratteri biologici originari • Lo sperimentatore per offrire significato scientifico ai propri risultati deve assicurare che: • Il tipo cellulare usato corrisponda agli standard depositati nelle banche cellulari • Non sia in alcun modo contaminato • Non abbia subito modificazioni biologiche a seguito delle condizioni di coltura Pratica della “banca cellulare” • Non è consigliabile mantenere (o programmare di mantenere) per lungo tempo in coltura una popolazione cellulare: • Rischio di contaminazioni • Perdita dei caratteri biologici di interesse • Deriva genetica • Limite di duplicazioni nelle cellule diploidi • Costi legati al mancato utilizzo • Il sistema della banca cellulare assicura: • Qualità costante • Esperimenti eseguiti ad un numero di passaggi comparabili • Le cellule sono coltivate solo quando servono • I caratteri biologici iniziali sono preservati Schema di banca cellulare Crioconservazione • Procedura che permette di preparare stock cellulari • Indicazioni generali: • Congelamento lento (pochi gradi al minuto) • Scongelamento rapido (subito a 37°C) • Vitalità superiore al 90% • Cellule in fase di crescita logaritmica • Alta percentuale di siero (>20%) • Criopreservante: DMSO (10%) o glicerolo • Conservazione a t<-135°C (vapori di azoto, o azoto liquido) • Sistema di catalogazione Regole base: cosa fare • Usare sempre camice e guanti. Protezioni particolari sono necessarie quando si maneggia l’azoto liquido • Pulire tutte le superfici prima di ogni operazione e tra operazioni diverse (o diverso operatore) • Identificare in maniera chiara tutti i contenitori che si usano • Tenere in ordine e mantenere le superfici di lavoro il più possibile sgombre da oggetti • Maneggiare una sola linea cellulare alla volta • Controllare i terreni giornalmente per la presenza di contaminazione o di altre alterazioni • Rispettare le scadenze di pulizia e di controllo di incubatore e cappa biologica Regole base: cosa non fare • Permettere l’accesso contemporaneo di più persone nel laboratorio • Manipolare cellule di dubbia origine nell’area principale di lavoro o contemporaneamente alle altre linee cellulari • Tenere le cellule in coltura per lungo tempo • Tenere le cellule per troppo tempo a confluenza • Usare terreni completi oltre le 6 settimane Procedura asettica 1 • Disinfettare la cappa con EtOH 70% • Disinfettare i guanti con EtOH 70% e lasciarli asciugare per 30 sec prima di iniziare • Disporre i reagenti sotto cappa dopo avere disinfettato le superfici esterne • L’ingresso delle mani nella cappa deve essere lento • Disinfettare tutto il materiale usato prima di portarlo fuori cappa Procedura asettica 2 • Avere sempre presente quali sono le superfici e i liquidi sicuramente sterili • Considerare la direzione del flusso di aria sterile • I terreni di coltura e gli scarti liquidi vanno neutralizzati con ipoclorito per almeno 2 ore Colture di cellule adese • la densità cellulare deve essere mantenuta all’interno di valori limite per: • Mantenere costante il tasso di crescita • Evitare la selezione di nuovi cloni • La crescita viene valutata come grado di confluenza Inibizione da contatto • Cellule normali quando vengono a contatto interrompono la loro proliferazione ed entrano in fase G0 • Le cellule trasformate e tumorali non risentono dell’inibizione da contatto Grado di confluenza • Quanta superficie di crescita è occupata dalle cellule • Quando le cellule coprono l’80% della superficie vanno spostate (passate) in un nuovo contenitore • Se lasciate ad un alto grado di confluenza per troppo tempo le cellule cambiano fenotipo e possono diventare più difficili da staccare • • Solitamente la crescita esponenziale si ha con valori di densità compresi tra 104 e 105 cellule per cm2 Colture di cellule adese Numero di cellule • La linea deve essere mantenuta a crescita esponenziale 2 3 4 5 6 7 Densità cellulare (10x) • Conoscenza della superficie di semina • Cellule seminate ad una confluenza troppo bassa entrano in uno stato di quiescenza e non proliferano Numero di passaggi • Il numero di volte che la coltura è stata passata («split») in un nuovo recipiente • Va sempre indicato sul contenitore • Si consiglia di usare le cellule non oltre un certo numero di passaggi per evitare le modificazioni fenotipiche indotte dalla coltura prolungata Protocollo: sottocoltura di cellule aderenti • Le cellule smettono di crescere quando raggiungono il 100% di confluenza o in seguito ad esaurimento dei fattori nutritivi • Le cellule vanno portate in sospensione • Si utilizzano proteasi, soluzioni di proteasi e agenti alchilanti o metodi meccanici Procedura (1) • Accertarsi della confluenza e dello stato delle cellule • Rimuovere il terreno • Lavare lo strato cellulare con PBS senza Ca2+ e Mg2+ con un volume equivalente a metà volume del terreno usato. Ripetere se le cellule hanno alta capacità adesiva • Aggiungere 1ml di tripsina/EDTA ogni 25cm2 di superficie. Fare in modo che il liquido bagni tutta la superficie • Mettere il contenitore in incubatore per 2-10 minuti Tripsina EDTA • La tripsina è un enzima proteolitico che permette il distacco delle cellule dalla piastra di coltura • La tripsina taglia i legami peptidici • EDTA chela gli ioni calcio nel terreno che inibiscono l’azione della tripsina • La tripsina si autodigerisce a 37°C dopo 20 minuti • Lasciare le cellule in incubazione con la tripsina ne riduce la vitalità Procedura (2) • Osservare le cellule al microscopio per accertarsi che • • • • • • siano in sospensione Agevolare il distacco meccanicamente Diluire le cellule in terreno contenente siero Centrifugare Scartare il surnatante e risospendere le cellule in un appropriato volume di terreno completo Contare le cellule Prelevare il volume contenente il numero di cellule necessario Punti cruciali • Diversi tipi cellulari hanno capacità adesive molto diverse • La presenza di EDTA aiuta il distacco delle cellule • L’eliminazione di siero è fondamentale per aumentare l’efficacia della tripsina • L’esposizione prolungata a tripsina può danneggiare irreversibilmente le cellule • La fase di centrifugazione può essere omessa se si usano elevate quantità di siero • La tripsina danneggia le proteine di superficie Procedura di conta • Centrifugare • Risospendere in un piccolo volume di terreno completo • Prelevare 100 ml di sospensione • Aggiungere un ugual volume di Trypan Blue (0,4%) • Riempire le camere del vetrino (5-10 ml) • Osservare al microscopio ad ingrandimento 20x • Calcolare il numero di cellule secondo le specifiche del vetrino di conta (dimensioni del reticolo) Trypan Blue • Colorazione per esclusione • Le cellule vive non assorbono il colorante • Le cellule morte con membrana rotta assorbono il colorante e si colorano di blu Camere di conta (emocitometri) • Vetrini speciali che presentano una griglia microscopica che serve per contare le cellule Calcolo del numero di cellule • A= media delle cellule vive • B= media delle cellule morte • C= fattore di diluizione • D= fattore di conversione in ml • Concentrazione cellule vive= A*C*D • Concentrazione cellule morte=B*C*D Volume della conta= 0,1x 1 mm2=0,1 mm3 Fattore di conversione= 104 (0,1 mm3=0,1ul= 10-4ml) Punti cruciali • Un’adeguata accuratezza della misura si ottiene contando • • • • • almeno 100 cellule Il Trypan blue è tossico ed è un potenziale carcinogeno Le cellule devono essere ben distinte e uniformemente distribuite Evitare la presenza di bolle e detriti Non riempire eccessivamente la camera Se le cellule sono poche, operare una nuova centrifugazione e risospendere in meno terrreno Calcolo della vitalità cellulare • Colorazione con Trypan Blue • Le cellule vive sono impermeabili al Trypan Blue mentre le cellule morte assorbono il colorante • Mescolare trypan blue con un’aliquota delle cellule da valutare • Conta alla camera di conta per stabile il numero di cellule vive (Nv) e il numero di cellule morte (Nm) • % di vitalità = (Nv X 100)/(Nv+Nm) Adesione cellulare ancoraggio migrazione – “homing” comunicazione - anoikis Tipologie di migrazione • Chemotassi: movimento guidato da un fattore solubile • Aptotassi: movimento guidato da sostanze presenti nella matrice extracellulare non diffusibili • Chemotropismo: crescita (senza movimento) dei tessuti verso una sostanza attraente Test di adesione • Valutazione della capacità delle cellule di aderire su un substrato fisiologico (collagene, fibronectina, laminina…) • Cerca di riprodurre le condizioni in vivo • La crescita su matrici biologiche modifica la morfologia e la capacità di crescita delle cellule • La presenza di proteine di matrice può stimolare la migrazione • L’adesione può essere un bersaglio farmacologico per impedire la diffusione del tumore Test di adesione • Conta cellulare (stesso numero di cellule per pozzetto) • Incubazione a 37°C per 30 minuti – 1 ora • Eliminazione delle cellule non adese • Fissaggio delle cellule • Colorazione delle cellule
Scaricare