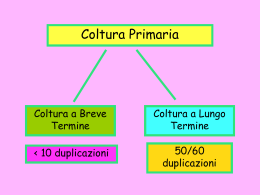
Oncologia Sperimentale di laboratorio PREVENZIONE DELLA CONTAMINAZIONE DELLE COLTURE CELLULARI E CONSERVAZIONE 6° S. Beninati CONTAMINAZIONE DA BATTERI E FUNGHI • ALCUNE PROCEDURE DI BASE VENGONO UTILIZZATE AL FINE DI RIDURRE LA CONTAMINAZIONE DELLE COLTURE CELLULARI • TRA I VARI ACCORGIMENTI, LA FILTRAZIONE DEL MEZZO DI COLTURA RAPPRESENTA UNO DEI MEZZI PIU’ EFFICACI PER PREVENIRE LA CONTAMINAZIONE DA BATTERI • A TAL FINE POSSONO ESSERE USATI FILTRI CON VARIE POROSITA’ A SECONDA DEL TIPO DI APPLICAZIONE: • • • • 0.8 μm………………………….PREFILTRAZIONE 0.45 μm ………………………..PREFILTRAZIONE CHIARIFICAZIONE 0.2 μm …………………….…...STERILIZZAZIONE 0.1 μm …………………………RITENZIONE DI MICOPLASMI PREFILTRAZIONE • LA PREFILTRAZIONE CON MEMBRANE DA 0.8 E 0.45 PERME DI FILTRARE I MEZZI CON I FILTRI DA 0.2 O 0.1 CON PIU’ RAPIDITA’. • TALE PREFILTRAZIONE E’ NECESSARIA IN PRESENZA DI SIERO FETALE BOVINO A CAUSA DELL’INTASAMENTO DEI FILTRI DA 0.2 • I FILTRI VENGONO PROVATI MISURANDONE LA RITENZIONE BATTERICA DALL’AMERICAN SOCIETY FOR TESTING AND MATHERIAL (ASTM) • 0.45 μm……..SERRATIA MARCESCENS ATCC 14756 • 0.2 μm…..PSEUDOMONAS DIMINUTA ATCC 19146 • IL PSEUDOMONAS DIMINUTA RAPPRESENTA UNO DEI PIU’ COMUNI CONTAMINANTI CAPACE DI ATTRAVERSARE LE MEMBRANE DA 0.45 μm LIMULUS AMEBOCYTE LYSATE TEST • LA FILTRAZIONE, PUR RENDENDO STERILE IL MEZZO NON RISOLVE IL PROBLEMA DELLA PRESENZA DELLE ENDOTOSSINE DI ORIGINE BATTERICA • AL FINE DI SAGGIARE LA PRESENZA DI ENDOTOSSINE SI UTILIZZA IL L. A. L. TEST (LIMULUS AMEBOCYTE LYSATE TEST) FILTRAZIONE • E’ OPPORTUNO FILTRARE IL MEZZO DI COLTURA, PREPARATO SOTTO CAPPA , A FLUSSO LAMINARE VERTICALE • IN TEORIA, PER ELIMINARE LA POSSIBILITA’ DI FORMARE SCHIUME, LA FILTRAZIONE DOVREBBE AVVENIRE CON PRESSIONE POSITIVA • IN PRATICA TUTTI I SISTEMI IN COMMERCIO SONO DI TIPO NEGATIVO, CIOE’ SFRUTTANDO IL VUOTO COME MEZZO DI MOVIMENTO FILTRAZIONE CON SIRINGA • LA SIRINGA CON APPLICATO UN FILTRO DA 0.22 μm E’ UN SISTEMA DI FILTRAGGIO A PRESSIONE POSITIVA OTTIMO IN GENERE PER PICCOLI VOLUMI (MAX 100 ml) • LA PRESSIONE PUO’ ESSERE UN PARAMETRO CRITICO IN TUTTI I SISTEMI CONSERVAZIONE DELLE CELLULE PER CRIOCONSERVAZIONE • LA CRIOCONSERVAZIONE E’ ATTUALMENTE L’UNICA TECNICA UTILIZZABILE PER CONSERVARE PER TEMPI LUNGHI LE CELLULE. • LA CONSERVAZIONE DELLE CELLULE PER TEMPI BREVI PUO’ ESSERE ATTUATA MANTENENDOLE SOSPESE NEL MEZZO DI COLTURA A 0-4 °C (AL MAX PER 2-3 GIORNI) VANTAGGI DELLA CRIOCONSERVAZIONE • I VANTAGGI DELLA CRIOCONSERVAZIONE SONO MOLTEPLICI: • E’ UNA METODICA RELATIVAMENTE ECONOMICA, RICHIEDE: AZOTO LIQUIDO CONSERVATO IN CONTENITORI ADATTI • PERMETTE IL RECUPERO DELLE CELLULE CON IL PATRIMONIO GENETICO INTATTO • I TEMPI DI CONSERVAZIONE SUPERANO I 50 ANNI • LE PROCEDURE DI CONGELAMENTO E SCONGELAMENTO SONO RELATIVAMENTE CRITICHE E LA RESA IN CRESCITA E’ GENERALMENTE ELEVATA PUNTI CRITICI • LA TEMPERATURA IDEALE DI CONSERVAZIONE NON DEVE SUPERARE I -135 °C • I PUNTI CRUCIALI DELLA PROCEDURA SONO IL CONGELAMENTO E LO SCONGELAMENTO, I QUALI INFLUENZANO LA SOPRAVVIVENZA CELLULARE • LA MORTALITA’ CELLULARE DERIVA ESSENZIALMENTE DALLO SHOCK-TERMICO AL QUALE LE CELLULE SONO SOTTOPOSTE • L’ABBASSAMENTO DELLA TEMPERATURA DEVE ESSERE OPPORTUNATAMENTE CONTROLLATO AL FINE DI RIDURRE LA MORTALITA’ CELLULARE PROTOCOLLO CONGELAMENTO • • • • MEZZO DI COLTURA CON IL CRIOCONSERVANTE: MEZZO TAMPONATO 65% SIERO 25% GLICEROLO 10% * • SOSPENDERE LE CELLULE NEL MEZZO(5-10·106 CELLULE / ml) • TRASFERIRE LE CELLULE IN PROVETTE DI CRIOCONSERVAZIONE • IMMERGERE LE PROVETTE CHIUSE IN ALCOOL 90° • • PORRE LE PROVETTE IN UNA SCATOLA DI POLISTIROLO E CONSERVARLE A -20°C PER 30’, QUINDI A -80°C PER 60’CONGELARE IN AZOTO LIQUIDO • * DMSO 10% TUTTO STERILE REGOLE GENERALI : • VELOCITA’ TROPPO LENTE DI CONGELAMENTO LA CELLULA E’ ESPOSTA A CONCENTRAZIONI CRESCENTI DI SOLUTI EXTRACELLULARI PER L’ELEMINAZIONE DI ACQUA TRASFORMATA IN GHIACCIO. • I DANNI PRODOTTI DAERIVANO DALLA VARIAZIONE DEL pH DEL MEZZO E DALLA PRESSIONE OSMOTICA ESTERNA (LE CELLULE PERDONO ACQUA) • VELOCITA’ DI RAFFREDDAMENTO TROPPO ELEVATE PROVOCANO LA FORMAZIONE DI NUCLEI DI CRISTALLIZZAZIONE SIA NEL MEZZO CHE ALL’INTERNO DELLE CELLULE. TALI NUCLEI SI TRASFORMANO IN GROSSI CRISTALLI DI GHIACCIO CON RELATIVO DANNO MECCANICO ALLE CELLULE • • LA VELOCITA’ DI RAFFREDDAMENTO OTTIMALE E’ STATA VALUTATA IN -1 °C AL MIN. (VALORE MEDIO) MEZZI UTILIZZATI PER EFFETTUARE IL RAFFREDDAMENTO – TRASFERIMENTO DEI VIALS CONTENENTI LE CELLULE DA CONGELARE IN UN CONTENITORE DI POLISTIROLO TRASFERITO IN FREEZER A -20 °C E QUINDI A -80° C (ESITONO CONTENITORI IN VENDITA) – FREEZER MECCANICI PROGRAMMABILI (PRECISI COSTOSI) E INFINE LE CELLULE VENGONO RISPOSTE IN AZOTO LIQUIDO. LO SBALZO TERMICO IN TAL CASO NON HA ALCUN EFFETTO NORME GENERALI PER LO SCONGELAMENTO DI CELLULE • VANTAGGI DEL CONGELAMENTO: ASSICURARSI DI CONSERVARE LA STABILITA’ GENETICA DELLE CELLULE POICHE’ SONO POSSIBILI MUTAZIONI O SELEZIONI CHE POSSONO ESSERE INDOTTE DALLA SUBCULTURA • PREPARAZIONE DELLE CELLULE PER LO SCONGELAMENTO: COME IL CONGELAMENTO ANCHE LO SCOGELAMENTO RAPPRESENTA UNA FASE CRITICA • LO SCONGELAMENO DEVE ESSERE RAPIDO DOPO AVER TOLTO LE CELLULE DALL’AZOTO LIQUIDO PORLE A 37°C IN UN BAGNOMARIA TEMPI DI RISCALDAMENTO • I TEMPI DI RISCALDAMENTO (37°C40°C) SONO DIVERSI A SECONDO DEL TIPO DI VIALS • • 1MINUTO PER VIALS DI VETRO 90SECONDI PER VIALS DI PLASTICA NORME GENERALI • E’ OPPORTUNO NON AGITARE LE VIALS E NON SUPERARE I TEMPI INDICATI. • PRIMA DI APRIRE I VIALS ACCERTARSI CHE NON SI SVILUPPINO BOLLE DAL PUNTO DI CONTATTO TRA IL TAPPO E IL CONTENITORE TALE SEGNO E’ UNA CHIARA INDICAZIONE DI ASSENZA DI ERMETICITA’. • LE CELLULE SONO SICURAMENTE CONTAMINATE O QUANTO MENO DANNEGGIATE DAL CONTATTO DIRETTO CON L’AZOTO LIQUIDO. • PRIMA DI TOGLIERE IL TAPPO LAVARE I VIALS CON ALCOOL PER RIDURRE LA CONTAMINAZIONE CICLO O CURVA DI CRESCITA* • * (IL CICLO O CURVA DI CRESCITA NON DEVE ESSERE CONFUSO CON IL CICLO CELLULARE O INTERFASE CHE CONDUCE ALLA MITOSI O ALLA MEIOSI) • È ESSENZIALE CONOSCERE I PARAMETRI RELATIVI AL CICLO DI REPLICAZIONE DELLE CELLULE DA COLTIVARE. • IL CICLO DI CRESCITA CONTROLLA INFATTI MOLTI PASSAGGI CHE SONO NECESSARI PER LA COLTURA DI CELLULE ANIMALI. • TRA I PIÙ IMPORTANTI RICORDIAMO: – – – – – LA DENSITÀ CELLULARE DI SEMINA IL TEMPO DI CRESCITA LA DURATA DI UN ESPERIMENTO IL MOMENTO ADATTO PER IL PRELIEVO DEI CAMPIONI IL METABOLISMO CELLULARE • È NECESSARIO CONSIDERARE, NEL PREPARARE UN ESPERIMENTO, CHE CELLULE CHE SI TROVANO IN FASI DIVERSE DEL CICLO DI CRESCITA SI COMPORTANO IN MODO DIVERSO RISPETTO A DIVERSI PARAMETRI BIOLOGICI COME: – – – – – ATTIVITÀ ENZIMATICHE PROLIFERAZIONE GLICOLISI E RESPIRAZIONE CELLULARE SINTESI DI PRODOTTI SPECIFICI INTERAZIONI CON LA MATRICE EXTRACELLULARE FASI DEL CICLO DI CRESCITA • IL CICLO DI CRESCITA È DIVISO IN TRE FASI: • FASE LAG • FASE LOG • FASE DI PLATEAU FASE LAG • CORRISPONDE AL TEMPO IMMEDIATAMENTE SUCCESSIVO ALLA SUBCULTURA E ALLA SEMINA. • IL NUMERO DI CELLULE CHE SI DIVIDE IN TALE FASE È MINIMO. • TALE PERIODO È ANCHE DETTO DI ADATTAMENTO. • DURANTE TALE FASE LE CELLULE RIPRISTINANO GLI ELEMENTI DELLE MEMBRANE CELLULARI PERSI IN SEGUITO ALLA TRIPSINIZZAZIONE (ANCHE DETTA PEELING, POICHÈ LE PROTEINE DI SUPERFICIE VENGONO TAGLIATE), SI ATTACCANO AL SUBSTRATO POICHÉ SINTETIZZANO LE PROTEINE DELLA MATRICE EXTRACELLULARE (FIBRONECTINA IN PARTICOLARE) E SI DISTRIBUISCONO SU TUTTA LA SUPERFICIE DISPONIBILE. • IL CITOSCHELETRO SI ASSEMBLA E MOLTI ENZIMI COME LA DNA POLIMERASI AUMENTANO, SEGUITI DALLA SINTESI DI NUOVO DNA E PROTEINE STRUTTURALI. FASE LOG • QUESTO È IL PERIODO DI AUMENTO NUMERICO ESPONENZIALE. • • • • LA DURATA DI QUESTA FASE È DIRETTAMENTE CORRELATA CON: 1. LA DENSITÀ DI SEMINA, 2. IL GRADO DI CRESCITA DELLE CELLULE IN QUELLE CONDIZIONI 3. LA DENSITÀ MINIMA DI INIBIZIONE DELLA PROLIFERAZIONE. • DURANTE QUESTA FASE IL NUMERO DI CELLULE IN DIVISIONE È MOLTO ALTO (~ 90-100% IN GENERE) E IL MODELLO È ALTAMENTE RIPRODUCIBILE. QUINDI È IL MOMENTO OTTIMALE PER RACCOGLIERE CAMPIONI, SIA PER LA RIPRODUCIBILITÀ CHE PER LA VITALITÀ CELLULARE ELEVATA. È BENE CONSIDERARE CHE LE CELLULE NON SONO SINCRONIZZATE, SI TROVANO CIOÈ DISTRIBUITE IN MANIERA RANDOM NEL CICLO CELLULARE. • • FASE DI PLATEAU • VERSO LA FINE DELLA FASE LOG, , LE COLTURE DIVENTANO CONFLUENTI OCCUPANDO TUTTA LA SUPERFICIE DISPONIBILE. • LA CRESCITA CELLULARE IN TALI CONDIZIONI È MOLTO RIDOTTA FINO A CESSARE. • LA FASE RAGGIUNTA È DETTA STAZIONARIA O DI PLATEAU. • LA MORFOLOGIA CELLULARE CAMBIA E IL BLOCCO DELLA MOTILITÀ, IL MUTAMENTO DELLE MEMBRANE CELLULARI E LA MANCANZA DI CRESCITA SONO DEFINITE COME “INIBIZIONE DA CONTATTO” (ALBERCOMBIE E HEAYSMAN, 1965). • IL TERMINE “INIBIZIONE DA CONTATTO” È STATO DEFINITO COME IMPRECISO, POICHÉ LA RIDUZIONE DELLA CRESCITA DELLE CELLULE NORMALI NON È DOVUTA ESCLUSIVAMENTE AL CONTATTO, MA PUÒ COINVOLGERE ALTRI FATTORI, TRA I QUALI LA MANCANZA DI NUTRIENTI E L’IMPOSSIBILITÀ DI COLONIZZARE NUOVI SPAZI. • • • SI PREFERISCE IL TERMINE “LIMITAZIONE DELLA CRESCITA DA DENSITÀ” (STOKER E RUBIN, 1967). IL TERMINE “INIBIZIONE DA CONTATTO” È TUTTAVIA CONSERVATO A QUEI CASI IN CUI IL CONTATTO FISICO È L’UNICO ELEMENTO LIMITANTE LA CRESCITA. DIPENDENZA DALLA ADESIONE CELLULARE • È NECESSARIO DISTINGUERE INIBIZIONE DA CONTATTO E INIBIZIONE DA DENSITÀ. • NEL PRIMO CASO, COME OGGETTO DEL CONTATTO SI CONSIDERANO LE CELLULE E IL LORO ANCORAGGIO. • NON CRESCONO LE CELLULE ALLE QUALI VIENE A MANCARE L’ANCORAGGIO CON IL SUBSTRATO. • • AD ESEMPIO LE CELLULE EPITELIALI E ENDOTELIALI NORMALI SMETTONO DI CRESCERE ALLA CONFLUENZA FORMANDO DEI MONOSTRATI. CELLULE TUMORALI • MOLTE COLTURE, RAGGIUNTA LA CONFLUENZA POSSONO CONTINUARE A PROLIFERARE (CELLULE TUMORALI) FORMANDO MULTISTRATI E SMETTONO DI CRESCERE PER MANCANZA DI NUTRIENTI. • • LE CELLULE TRASFORMATE POSSONO RAGGIUNGERE ALTE DENSITÀ NELLA FASE STAZIONARIA. • LA FRAZIONE IN CRESCITA È MOLTO ALTA E LA INIBIZIONE DA DENSITÀ È NULLA. CURVA DI CRESCITA • DALLA COSTRUZIONE DI UNA CURVA DI CRESCITA SI POSSONO DEDURRE VARI PARAMETRI: • IL PERIODO DEL LAG (“LAG TIME”) • IL TEMPO DI RADDOPPIAMENTO • (“DOUBLING TIME”) • LA SATURAZIONE DI DENSITÀ (“SATURATION DENSITY”) LAG TIME • 1 → SI OTTIENE DISEGNANDO UNA LINEA DALLA CURVA DI LOG TIME FINO AD INTERSECARE LA CONCENTRAZIONE IN CELLULE/ml DELL’INOCULO. LOG TIME • 2 → RAPPRESENTA IL TEMPO NECESSARIO ALLE COLTURE PER AUMENTARE DEL DOPPIO NEL CENTRO DELLA FASE LOG (QUESTO E’ UN PARAMETRO CARATTERISTICO PER OGNI LINEA CELLULARE) DT-DOUBLING TIME PLATEAU • 3 → RAPPRESENTA LA CONCENTRAZIONE DELLE CELLULE NELLA FASE STAZIONARIA. S.D. saturation density CURVA DI CRESCITA DI DUE LINEE CELLULARI (HELA E NFL). LA LINEA INTERA È PER LE HELA E QUELLA TRATTEGGIATA PER LE NFL. DTDOUBLING TIME;NFL-NORMAL FETAL LUNG FIBROBLAST; *-SE IL MEZZO DI COLTURA NON VIENE SOSTITUITO LE CELLULE MUOIONO; SDSATURATION DENSITY. Colture primarie • Una coltura primaria viene generata isolando cellule direttamente a partire da tessuti o organi, le cellule isolate in questo modo riflettono meglio le attività biochimiche delle cellule in vivo, tuttavia hanno una vita limitata e, per la realizzazione di progetti a lunga scadenza, è necessario prevedere diversi isolamenti. • Per procedere all’isolamento di una coltura primaria da tessuto occorre tener presente che un tessuto è composto di tipi cellulari diversi, tenuti insieme da matrice; è quindi necessario rompere la matrice per separare le cellule procedendo poi alla selezione dei tipi cellulari necessari per gli scopi sperimentali. procedura • La procedura prevede che il campione di tessuto sia trattato con tripsina e collagenasi allo scopo di digerire la matrice extracellulare, e con EDTA allo scopo di chelare il Ca++ da cui dipende l’adesione cellula-cellula. Dalla sospensione cellulare ottenuta si ottiene una coltura primaria. Le cellule della coltura primaria aderiscono alla piastra e crescono fino a coprire tutta la superficie disponibile. A questo punto vengono rimosse dalla piastra di coltura e sistemate in nuove piastre. Le colture primarie non sono sterili, quindi è obbligato l’uso di antibiotici. Tipi di colture • A seconda che la coltura richieda di aderire ad una superficie o cresca in un mezzo liquido, si distinguono colture adese da quelle in sospensione. • Alcuni tipi cellulari, caratterizzati da crescita adesa, per effetto dell’inibizione da contatto, smettono di proliferare quando formano un monostrato. • Le superfici di coltura più comuni erano le capsule di Petri, attualmente sono i micropozzetti e le fiasche, disponibili in varie misure e composte da materiale plastico trattato opportunamente in modo da esporre cariche negative che favoriscano l’adesione cellulare. CAPSULA PETRI MICROPOZZETTI FIASCHE Immortalizzazione • Dopo un certo numero di duplicazioni (variabile per tipo cellulare), le cellule primarie smettono di dividersi e muoiono per effetto dell’ accorciamento dei telomeri. • Per ottenere una linea cellulare capace di proliferare illimitatamente (linea cellulare continua), è necessario immortalizzare la coltura; esistono diversi metodi per ottenere questo risultato, per esempio: • Introduzione del gene esogeno che codifica per la subunità catalitica della telomerasi • Utilizzo di oncogeni derivati da virus tumorali (antigene T di SV40), che innescano meccanismi di trasformazione simili a quelli che determinano la proliferazione tumorale. Hela • Cellule provenienti da tessuti tumorali sono linee cellulari naturalmente immortalizzate, non a caso la prima linea cellulare continua è stata isolata da George Gey nel 1951 da tessuto tumorale di cervice uterina (Hela). linee cellulari • La possibilità di produrre linee cellulari continue permette di ridurre la variabilità sperimentale legata all’utilizzo di colture primarie garantendo maggiore riproducibilità. • Nell’analisi dei risultati occorre però tenere presente che la coltura immortalizzata è in genere più lontana dalle condizioni fisiologiche dell’organismo di partenza. linee cellulari continue • Diverse strutture si sono negli ultimi anni specializzate nella conservazione e propagazione di cellule su larga scala; sono infatti commercialmente disponibili per i ricercatori di tutto il mondo diverse collezioni di linee cellulari, per esempio : • ATCC - American Type Culture Collection • DSMZ - German Collection of Microorganisms and Cell Cultures • ECACC - European Collection of Animal Cell Culture LINEE CELLULARI • Ciascuna di queste collezioni fornisce, oltre alla possibilità di acquistare la linea cellulare di interesse, anche informazioni sperimentali a corredo che riguardano sia il protocollo di mantenimento della linea in coltura, ma anche la specie e il tessuto di provenienza, le modalità di isolamento ed altre notizie utili al ricercatore. Alcune di queste linee sono: • p-19 , Hela , Huvec , NIH 3T3 , Neuro 2A , PC12, PC3, B16-F1, B16-F10 Condizioni di coltura • Poichè all’interno dell’organismo esistono specifici sistemi di controllo che regolano funzioni vitali come nutrizione, controllo del pH, protezione, mantenimento della temperatura, la coltivazione di cellule in vitro deve avvenire assicurando il mantenimento delle stesse condizioni fisico-chimiche, per questo sono fondamentali le funzioni svolte dal terreno di coltura e dagli strumenti usati per l’incubazione. • I parametri fisico-chimici da controllare comprendono: • • • • • - il pH -La tensione di CO2 -Sistemi tampone - Temperatura ottimale per la crescita -La tensione di vapore all’interno dell’incubatore CONTROLLO TEMPERATURA, TENSIONE DI VAPORE E % DI CO2
Scaricare