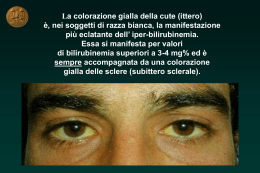
Sezione ECM Ittero colestatico: c’è ancora un ruolo per la clinica? Mauro Maurantonio, Leonardo Venezia, Lucia Carulli, Silvia Lombardini*, Chiara Gabbi*, Mario De Santis**, Gabriele Luppi***, Giampiero Rigo§, Nicola Carulli (Ann Ital Med Int 2004; 19: 131-142) TABELLA I. Principali indici bioumorali. PRESENTAZIONE CLINICA Descriviamo i casi di 2 pazienti giunti alla nostra osservazione con la stessa sintomatologia, dalla cui discussione emerge l’importanza della valutazione clinica complessiva nel processo diagnostico. Caso 1 Mauro Maurantonio, Leonardo Venezia, Chiara Gabbi Il primo caso riguarda un paziente di 59 anni, che giunge alla nostra osservazione per la comparsa, nella settimana precedente il ricovero, di ittero, urine ipercromiche e feci ipocoliche. Non erano riferiti sintomi attribuibili a colica biliare. Gli esami bioumorali mostravano elevazione degli indici di colestasi, segni di citolisi epatica, aumento degli indici di flogosi (Tab. I). Non altri segni bioumorali di insufficienza epatica o di necrosi pancreatica. Si segnalava l’incremento del marcatore neoplastico CA 19.9 fino a 424 U/mL (range 0-37 U/mL); negativi gli altri marker (alfa-fetoproteina, antigene carcinoembrionarioCEA). Nella norma gli indici di funzionalità tiroidea e negativa la ricerca dei marker epatitici HBsAg e anti-HCV. L’esame obiettivo confermava il colorito itterico di cute e mucose, qualche fine crepitio alla base del polmone sinistro, non linfoadenomegalie superficiali palpabili. Presenza di tasca sottocutanea in sede pettorale sinistra in paziente portatore di pacemaker per bradicardia postinfarto miocardico acuto, addome trattabile, con modesta epatomegalia. L’ecografia addominale evidenziava: dilatazione delle vie biliari intraepatiche e della via biliare principale (ca- Indici bioumorali Valore riscontrato (range di normalità) Bilirubinemia totale (mg/dL) Bilirubinemia diretta (mg/dL) Gamma-glutamiltranspeptidasi (mg/dL) Fosfatasi alcalina (mg/dL) Acidi biliari (µmol/L) AST 165 U/L; ALT 206 U/L VES prima ora (mm) Ferritinemia (ng/mL) Fibrinogenemia (mg/dL) 14.4 (0.8-1.2) 12.1 261 (fino a 50) 848 (98-280) 33.3 (0-10) fino a 41 40 (1-12) 725 (25-400) 518 (200-400) ALT = alanina aminotransferasi; AST = aspartato aminotransferasi; VES = velocità di eritrosedimentazione. libro 1.4 cm) senza sicure immagini riferibili a calcoli; colelitiasi; in sede ilare, presenza di area disomogenea del diametro di circa 2 cm, a contorni mal definiti, compatibile con sospetta eteroplasia. Nella norma gli altri reperti ecografici. La tomografia assiale computerizzata (TAC) dell’addome confermava l’ectasia delle vie biliari e rilevava, allo sbocco del coledoco sulla papilla, area rotondeggiante con impregnazione con mezzo di contrasto in sede periferica, suggestivo per “ampulloma”; non linfonodi ingranditi. Non fu possibile eseguire colangiopancreatografia in risonanza magnetica (colangio-RM) in quanto il paziente era portatore di pacemaker. Allo scopo di visualizzare la massa descritta dagli esami strumentali ed eseguire biopsia per esame istologico, veniva eseguita colangiopancreatografia retrograda endoscopica (ERCP), che mostrava una papilla regolare, in particolare senza aspetti riferibili ad ampulloma. Nonostante il consulente chirurgo ponesse indicazione ad intervento urgente di asportazione della sospetta massa neoplastica, l’operazione fu posticipata per la progressiva riduzione degli indici di colestasi, di citolisi epatica e del marcatore CA 19.9. È stata quindi eseguita ultrasonografia delle vie biliari e della papilla di Vater per via endoscopica (ecoendoscopia-EUS), che ha permesso di escludere una patologia neoplastica alla base del quadro clini- Dipartimento di Medicine e Specialità Mediche, Struttura Complessa di Medicina 3 (Direttore: Prof. Nicola Carulli), Azienda Ospedaliera-Universitaria di Modena *Scuola di Specializzazione in Medicina Interna (Direttore: Prof. Nicola Carulli), Università degli Studi di Modena e Reggio Emilia **Dipartimento Servizi Diagnostici (Direttore: Dr. Ennio Gallo), ***Dipartimento di Oncologia ed Ematologia (Direttore: Prof. Pierfranco Conte), §Dipartimento di Medicine e Specialità Mediche, Struttura Semplice di Endoscopia Digestiva (Responsabile: Dr. Giampiero Rigo), Azienda Ospedaliera-Universitaria di Modena © 2004 CEPI Srl 131 Ann Ital Med Int Vol 19, N 2 Aprile-Giugno 2004 co: dopo papillo-sfinterotomia, veniva rimosso un calcolo incuneato a livello del coledoco terminale. Nei giorni seguenti, si confermava la normalizzazione degli indici di colestasi e del marker CA 19.9, e il paziente è stato quindi colecistectomizzato per via videolaparoscopica ed è attualmente in buona salute. lesionale. La massa presentava un diametro massimo di circa 5-7 cm e provocava anche marcata dilatazione uniforme del dotto di Wirsung (7.5 mm) con dilatazione delle vie biliari intraepatiche; colecisti molto distesa e ripiena di sludge biliare (eco-Courvoisier). Fegato lievemente aumentato di dimensioni, a margini regolari ed ecostruttura disomogenea, con multipli noduli iperecogeni omogenei a margini regolari e netti, non alonati, di dimensioni inferiori al cm, non vascolarizzati al color e power Doppler, riferibili verosimilmente ad angiomi epatici multipli; nella norma gli altri reperti addominali. La TAC dell’addome confermava l’ampia formazione ipodensa di 4.7 cm di diametro massimo a livello della testa e del processo uncinato del pancreas determinante ectasia delle vie biliari intra ed extraepatiche e del dotto di Wirsung; a livello dell’ottavo segmento epatico lesione di 2.8 cm con modica impregnazione contrastografica; altra formazione analoga di 1 cm di diametro era presente al settimo segmento. Non linfoadenomegalie; negativa la radiografia del torace per lesioni pleuro-parenchimali. Il reperto era suggestivo per ostruzione biliare da neoplasia del pancreas, con metastasi epatiche. L’agobiopsia del nodulo epatico, eseguita sotto ecoguida non mostrava, però, alcuna evidenza di lesione neoplastica. Durante la degenza si è assistito ad un incremento della bilirubinemia, della concentrazione del marcatore CA 19.9 (fino a 1070.0 U/mL) e riduzione degli altri indici di colestasi. Il consulente chirurgo non poneva indicazione ad asportazione della massa pancreatica, in considerazione della verosimile presenza di metastasi epatiche e confermava la necessità di diagnosi istologica. La biopsia pancreatica eseguita in EUS non evidenziava lesione neoplastica. Il paziente, rifiutando l’esecuzione di agobiopsia percutanea TAC-guidata della massa pancreatica, veniva sottoposto ad ERCP con posizionamento di stent biliare e successiva graduale scomparsa dell’ittero. Dimesso successivamente e in trattamento con insulina ed enzimi digestivi pancreatici, ha mantenuto, per qualche tempo, discrete condizioni generali. Permaneva, tuttavia elevato il marcatore CA 19.9. Le condizioni generali del paziente sono progressivamente decadute e indagini ripetute hanno confermato l’ipotesi diagnostica di neoplasia non trattabile chirurgicamente, sebbene non dimostrata istologicamente. Il paziente è deceduto dopo 3 anni dall’osservazione iniziale, senza riscontro autoptico. Caso 2 Mauro Maurantonio, Leonardo Venezia, Silvia Lombardini Il secondo caso riguarda un paziente di 61 anni, ex-donatore volontario di sangue, che giunge al ricovero per la comparsa di ittero, urine ipercromiche e feci ipocoliche. In precedenza, riscontro casuale di iperglicemia a digiuno associata a poliuria, polidipsia, astenia e calo ponderale, con successiva diagnosi di diabete mellito di tipo 2 e prescrizione di terapia con ipoglicemizzanti orali, sostituiti poi da insulina sottocute. Non erano riportati sintomi suggestivi per colica biliare, ma il paziente riferiva precedente emissione di calcolo urinario asintomatico e litiasi della ghiandola sottomandibolare, trattata, con beneficio, mediante litotripsia. Obiettivamente, il paziente si presentava itterico, senza epatosplenomegalia, con piccolo nodulo tiroideo palpabile. Gli esami bioumorali mostravano quadro di colestasi con segni di epatocitolisi (Tab. II). Inoltre, iperglicemia a digiuno (187 mg/dL) con glicosuria (circa 3 g/24 ore). Non altri segni bioumorali di insufficienza epatica o di necrosi pancreatica. Nella norma gli altri indici bioumorali di routine e gli indici di funzionalità tiroidea. Aumento del marcatore neoplastico CA 19.9 (> 240 U/mL); nella norma i valori di alfa-fetoproteina e CEA. L’ecografia dell’addome mostrava marcata dilatazione della via biliare principale (diametro 17 mm) causata da massa solida disomogenea prevalentemente ipoecogena, localizzata a livello della testa del pancreas e interessante prevalentemente il processo uncinato della ghiandola con, al power Doppler, vascolarizzazione peri- ed intra- TABELLA II. Principali indici bioumorali alterati. Indici bioumorali Valore riscontrato (range di normalità) Bilirubinemia totale (mg/dL) Bilirubinemia diretta (mg/dL) Gamma-glutamiltranspeptidasi (mg/dL) Fosfatasi alcalina (mg/dL) AST 179 U/L; ALT 372 U/L VES prima ora (mm) Fibrinogenemia (mg/dL) 2.26 (0.8-1.2) 1.40 2146 (fino a 50) 3551 (98-280) fino a 41 22 (1-12) 513 (200-400) LA SINDROME COLESTATICA Lucia Carulli, Mauro Maurantonio Il termine colestasi definisce una sindrome clinica ad eziologia multipla, caratterizzata dalla ritenzione nel fegato e nel compartimento ematico di sostanze normalmente Abbreviazioni come in tabella I. 132 Mauro Maurantonio et al. TABELLA III. Classificazione delle sindrome colestatiche. secrete nella bile, causata da alterazioni congenite o acquisite delle strutture e/o dei meccanismi responsabili della secrezione biliare, oppure dalla presenza di lesioni ostruttive dell’albero biliare intra o extraepatico1. Recenti acquisizioni hanno permesso una classificazione delle sindromi colestatiche su base fisiopatologica (Tab. III)2. La storia naturale delle sindromi colestatiche può schematicamente comprendere una catena di eventi che includono: 1) le alterazioni responsabili del fallimento della secrezione biliare; 2) gli effetti legati alla riduzione del flusso della bile sulle cellule parenchimali epatiche; 3) il coinvolgimento di altri tipi cellulari e l’innesco di processi infiammatori e fibrogenetici fino all’eventuale rimaneggiamento strutturale del fegato. Il quadro bioumorale e clinico è generalmente correlato all’entità e alla durata della patologia (Tab. IV)3. Sul versante bioumorale l’aumentata concentrazione di acidi biliari nel siero costituisce, per definizione, il segno più sensibile di colestasi. Esso tuttavia manca di specificità potendo occorrere in situazioni, quali la cirrosi epatica, in cui la colestasi non è l’elemento caratterizzante o il solo meccanismo patogenetico. Al contrario, vi possono essere situazioni di colestasi zonali che non compromettono il circolo enteroepatico degli acidi biliari e quindi non si accompagnano ad aumento della loro concentrazione sierica. Indicatore sensibile e specifico correntemente utilizzato nella pratica clinica è costituito dall’aumento della concentrazione sierica di attività enzimatiche quali la fosfatasi alcalina e gamma-glutamiltranspeptidasi, anche se in alcune forme di colestasi legate a difetto di trasportatori epatocitari (PFIC 1 e 2), la loro concentrazione rimane nei limiti della norma. La ritenzione e il passaggio in circolo di lipidi biliari quali fosfolipidi e colesterolo spiegano l’ipercolesterolemia e la presenza, in circolo, di lipoproteine anomale, che però sono ad appannaggio di colestasi protratte. L’iperbilirubinemia non è segno precoce di colestasi ma è un importante indicatore prognostico4. L’aumento delle transaminasi nel siero testimonia il danno epatocitario. Questo è proporzionale, entro certi limiti, all’entità della colestasi ma soprattutto alla modalità di insorgenza, essendo più significativa nelle colestasi che si instaurano in maniera acuta. Nel quadro clinico l’ittero non è sempre presente, in ogni modo è tardivo rispetto all’aumento della fosfatasi alcalina o addirittura al prurito. Tuttavia, in caso di ostruzione biliare acuta, specie delle grosse vie, può essere il primo segno di stasi biliare. Colestasi epatocitarie Congenite Alterazione della sintesi degli acidi biliari Alterazioni dei trasportatori della membrana epatocitaria Colestasi intraepatica familiare progressiva tipo 1 Colestasi intraepatica familiare progressiva tipo 2 Colestasi ricorrente benigna Epatopatie metaboliche Malattia di Wilson Emocromatosi Protoporfiria Galattosemia Intolleranza al fruttosio Tirosinemia Morbo di Gaucher Morbo di Newman-Pick Colangiopatie Congenite Colestasi intraepatica familiare progressiva tipo 3 Fibrosi cistica Errori di sviluppo della placca duttale Varietà atresica Atresia biliare extraepatica Varietà fibrocistica Malattia di Caroli Policistosi renale autosomica dominante e recessiva Fibrosi epatica congenita Complessi di von Meyemburg Paucità dei dotti biliari intraepatici Displasia arteriopatica (sindrome di Alagille) Paucità non sindromica Trisomia 17, 18, 21 Sindrome di Turner Deficienza di alfa1-antitripsina Colestasi epatocitarie Acquisite Epatiti virali Epatiti da farmaci e tossici Epatite autoimmune Infezioni sistemiche Nutrizione parenterale totale Gravidanza Postintervento Ipertiroidismo Colangiopatie Acquisite Immunologiche Cirrosi biliare primitiva Colangite autoimmune Sindrome da overlap Colangite sclerosante primaria Malattia cronica del trapianto verso l’ospite Rigetto di trapianto epatico Sarcoidosi ed altre granulomatosi Infettive Colangite batterica Infezioni virali Infestazioni da protozoi Neoplastiche Tossiche o da farmaci Ischemiche Duttopenie idiopatiche Ostruzione dell’albero extraepatico 133 Ann Ital Med Int Vol 19, N 2 Aprile-Giugno 2004 TABELLA IV. Sindrome colestatica. Alterazioni fisiopatologiche Correlati clinici Ritenzione di costituenti biliari Acidi biliari Iperbileacidemia Ipertransaminasemia ? prurito Ittero Ipercolesterolemia Xantelasmi, xantomi Lipoproteine anomale Alterazioni eritrocitarie Aumento sierico di fosfatasi alcalina, gamma-glutamiltranspeptidasi Anello di Kayser-Fleischer (morbo di Wilson) Bilirubina Lipidi Attività enzimatiche Rame Ridotta concentrazione di maldigestione e malassorbimento acidi biliari nell’intestino: dei grassi e vitamine liposolubili Grassi neutri Steatorrea Calo ponderale Diminuita visione notturna Osteoporosi, osteomalacia Neuropatia Allungamento tempo di protrombina Vitamina A Vitamina D Vitamina E Vitamina K ? = la relazione tra acidi biliari e prurito è dubbia. Da Carulli et al.3, modificata. Il prurito non è un sintomo costante e richiede una funzione epatica conservata; nella cirrosi biliare rappresenta spesso l’apertura del quadro clinico. Nelle forme di colestasi croniche, l’ipercolesterolemia può dar luogo a depositi di colesterolo piani, definiti xantelasmi, evidenti nelle regioni periorbitali e nelle pieghe palmari e, più tardivamente, a depositi rilevati, definiti xantomi, localizzati nelle regioni sottoposte a sfregamento (polsi, gomiti, ginocchia). La mancanza di un’adeguata concentrazione di acidi biliari nei primi tratti del tenue può dar luogo, nella colestasi protratta, ad alterazioni digestive e assorbitive di grassi e sostanze liposolubili. In queste condizioni, la steatorrea è un segno costante e si accompagna eventualmente a calo ponderale5. Nell’ambito delle carenze vitaminiche, il quadro più complesso è quello relativo a malassorbimento di vitamina D e calcio responsabile di alterazioni ossee, tra cui osteoporosi e osteomalacia, comprese nel termine di osteodistrofia epatica6. L’approccio clinico deve mirare a definire la possibilità di trattamento causale o radicale della sindrome colestatica, distinguendo, in pratica, forme che è possibile affrontare, allo stato attuale, solo con una terapia sintomatica, da ostruzioni biliari dell’albero extraepatico, passibili di intervento eventualmente risolutivo. In un algoritmo diagnostico delle sindromi colestatiche (Fig. 1)3, specie nei soggetti adulti, il primo livello di accertamento riguarda l’esclusione di un’ostruzione biliare extraepatica. Le informazioni cliniche derivanti dall’anam- nesi, l’esame fisico, il quadro bioumorale di base e l’ecografia hanno un valore predittivo negativo del 98% dei casi, che basta ad escludere con confidenza la presenza di un’ostruzione7. In assenza di un’evidente patologia ostruttiva extraepatica, l’approccio diagnostico include una serie di indagini dettate sempre dall’osservazione clinica. L’esame istologico del fegato può evidenziare alterazioni caratteristiche e comunque risulta utile per studiare l’evoluzione della patologia epatica. Indagini bioumorali specifiche quali la ricerca di marcatori di virus epatitici o la valutazione di autoanticorpi circolanti hanno indubbio valore per la diagnosi eziologica. Lo studio dell’eziopatogenesi di alcune forme di colestasi, specie in età pediatrica, è possibile oggi con l’uso di procedure analitiche sofisticate. Alterazioni della sintesi di acidi biliari, come causa di colestasi, sono oggi identificabili attraverso l’analisi spettrometrica di liquidi biologici che evidenziano una ridotta o assente sintesi di acidi biliari o la presenza di acidi biliari anomali o steroli, conseguente al difetto enzimatico corrispondente8. Parimenti, analisi genetiche e la valutazione dell’espressione di geni responsabili delle proteine di trasporto epatocitario rendono possibile tracciare il difetto responsabile di alcune forme di colestasi congenite a diversa espressione clinica9. Certamente, nelle forme di colestasi da patologia dell’albero biliare extraepatico (Tab. V), la diagnostica per immagini e le possibilità di intervento hanno nettamente cambiato lo scenario di non molti anni fa. 134 Mauro Maurantonio et al. FIGURA 1. Sindrome colestatica: flow-chart diagnostica. ERCP = colangiopancreatografia retrograda endoscopica; RMN = risonanza magnetica nucleare; PTC = colangiografia percutanea transepatica; TAC = tomografia assiale computerizzata. Da Carulli et al.3. TABELLA V. Cause più comuni di ostruzione dell’albero biliare extraepatico. radicale del problema o della scelta di possibilità di trattamento sintomatico, in ogni modo utili a migliorare la prognosi e/o la qualità di vita. La diagnostica per immagini (ecografia dell’addome, TAC, colangio-RM, EUS, ERCP, colangiografia percutanea transepatica) ha archiviato il vecchio e classico dilemma di “ittero medico o chirurgico” attraverso la possibilità di evidenziare le vie biliari e quindi informare sul livello dell’ostacolo. Tuttavia, non sempre essa fornisce una risposta definitiva circa la natura dell’ostacolo, perciò è sempre indispensabile valorizzare tutte le informazioni a disposizione. La concentrazione sierica dei marcatori biologici di neoplasia, sempre più utilizzati nella pratica corrente, utile soprattutto a monitorare l’effetto di trattamenti farmacologici, radioterapici o chirurgici sulla massa neoplastica, può rivestire significato diagnostico quando raggiunge valori elevati, mentre ha una predittività molto bassa in un range di valori definito “aspecifico”. Le informazioni derivanti da un’attenta anamnesi e dal quadro clinico e di laboratorio del paziente sono insostituibili nel disegnare il contesto critico in cui utilizzare in maniera mirata altre indagini diagnostiche, spesso invasive e costose, e decidere il trattamento migliore. Oltre all’età del paziente, che può collocarsi in una fascia di età in cui è più alta la prevalenza dell’una o dell’altra patologia colestatica, la storia di episodi di colica biliare o la presenza di colelitiasi depone per una coledo- Ostruzioni non neoplastiche Coledocolitiasi Stenosi Infiammatorie Colangite sclerosante primaria Pancreatite cronica Radioterapia Postchirurgiche Colecistectomia Anastomosi biliodigestiva Resezioni epatiche estese Trapianto di fegato Traumatiche Idiopatiche Ostruzioni neoplastiche Carcinoma della colecisti Colangiocarcinoma Carcinoma periampollare (pancreatico, ecc.) Adenoma dell’ampolla Stenosi da linfonodi metastatici IL PROBLEMA CLINICO Nicola Carulli, Mauro Maurantonio I 2 casi descritti sono caratteristici di una “sindrome colestatica da ostruzione delle vie biliari extraepatiche”. In tali situazioni, il problema clinico è quello di definire la natura dell’ostruzione in vista di una possibile soluzione 135 Ann Ital Med Int Vol 19, N 2 Aprile-Giugno 2004 colitiasi, mentre un precedente intervento di colecistectomia e ripetuti episodi di colangite fanno propendere per la presenza di una stenosi benigna postchirurgica. Una storia muta per episodi riferibili a patologia delle vie biliari, che però segnala l’occorrenza di un calo ponderale associato ad astenia non attribuibile a causa evidente, deve far prendere in considerazione una neoplasia. La dilatazione delle vie biliari evidente all’indagine ecografica, quando non è un reperto casuale, è di solito conseguente ad accertamenti eseguiti per la definizione di un ittero o di alterazioni del quadro bioumorale. In questo ambito, le modalità di insorgenza della sindrome colestatica e il quadro bioumorale forniscono informazioni oltremodo utili. La presenza di un’elevata concentrazione sierica di fosfatasi alcalina e gamma-glutamiltranspeptidasi, in assenza di ittero o con modesta iperbilirubinemia, depone per la presenza di una stenosi instauratasi gradualmente, tanto da provocare ipertensione nell’albero biliare sufficiente a produrre dilatazione dell’albero biliare stesso ed iperenzimemia, senza compromettere la clearance biliare di bilirubina. La quantità di bilirubina eliminata giornalmente è dell’ordine di milligrammi rispetto ai grammi (circa 4-5) di acidi biliari; questo rende ragione della precocità dell’aumento degli acidi biliari nel siero, ed eventualmente del prurito, rispetto alla comparsa di ittero. Questa situazione è suggestiva di una patologia ostruttiva graduale, caratteristica della crescita neoplastica. Viceversa, l’instaurarsi dell’ostruzione in breve tempo comporta un brusco aumento della pressione nell’albero biliare che si scarica fino a livello epatocitario producendo danno cellulare responsabile dell’ipertransaminasemia, più precoce e di entità maggiore, dell’aumento della gamma-glutamiltranspeptidasi e della fosfatasi alcalina. Sulla scorta di ipotesi diagnostiche ben fondate sul quadro clinico, l’utilizzazione mirata delle procedure endoscopiche e radiologiche assume sempre più una prospettiva terapeutica oltre che diagnostica. litiasi, la colangio-RM per la sua elevata sensibilità (92100%) e specificità (89-100%), può costituire l’esame da eseguire prima dell’eventuale esecuzione dell’ERCP10-12. In caso di evidenza ecografica di ostruzione maligna delle vie biliari, l’iter diagnostico dipende dalle condizioni generali del paziente e dalla possibilità di trattamento radicale. Prima dell’eventuale ERCP, che permette manovre anche terapeutiche, la colangio-RM, assieme alla RM convenzionale dell’addome, fornisce maggiori informazioni su tipo e sede del tumore, con una sensibilità dell’8296% e una specificità del 77-97.6%, consentendone la stadiazione12-15. Se la natura dell’ostruzione delle vie biliari non è definita dall’indagine ecografica, la colangio-RM dovrebbe essere preferita all’ERCP come primo esame di approfondimento, come anche nel sospetto di ostruzione delle vie biliari senza dilatazione del coledoco16. Nella diagnosi di carcinoma ampullare (“ampulloma”), soprattutto intraduttale, la colangio-RM ha una sensibilità dell’81-89% ed una specificità dell’84-100%11,12. Sebbene l’ERCP rimanga l’esame principale, fornendo la visione endoscopica dell’ampolla ed eventuali biopsie per esame istologico, la presenza alla colangio-RM di segni “indiretti” quali il riscontro del segno del “doppio binario” (espressione dell’ostruzione del dotto pancreatico e biliare comune insieme) permette la diagnosi differenziale tra il carcinoma della testa del pancreas e il carcinoma distale del dotto biliare comune17-19. Alcuni studi evidenziano come la colangio-RM, gravata da minori insuccessi “operatore-dipendenti” e in grado anche di discriminare le forme di colestasi conseguenti a cicatrici chirurgiche sul tratto intestinale o a stenosi organiche, rappresenta una valida alternativa all’ERCP diagnostica, nelle colestasi ostruttive13,17-22. Se la colangio-RM non può essere utilizzata (ad esempio protesi meccaniche), l’uso dell’ERCP può aumentare l’accuratezza diagnostica, dopo l’ecografia, nella diagnosi delle colestasi ostruttive23. Quest’ultima metodica, che tuttavia presenta una morbilità non trascurabile, oltre a confermare la diagnosi attraverso la visualizzazione diretta dell’ostacolo e a permettere di eseguire un “brushing” delle vie biliari per isolare cellule neoplastiche, offre le potenzialità di estrarre direttamente i calcoli e di posizionare endoprotesi24. L’utilizzo dell’EUS, nell’iter diagnostico è ancora dibattuto. La procedura richiede un operatore esperto ed è ancora poco diffusa, ma ha il vantaggio di poter effettuare una biopsia guidata con ago sottile, con successo della procedura del 90%, accuratezza variabile dal 45% dei tumori neuroendocrini all’85% degli adenocarcinomi, e modesta incidenza di complicanze minori (sanguinamento, dolore LA DIAGNOSTICA PER IMMAGINI NELL’OSTRUZIONE BILIARE EXTRAEPATICA Mauro Maurantonio, Mario De Santis, Giampiero Rigo Dopo la necessaria valutazione clinica, l’esecuzione di ecografia (ultrasonografia) permette di differenziare una forma da ostruzione extraepatica da forme di colestasi intraepatica (Fig. 1)3. In caso di sospetta coledocolitiasi, la positività ecografica, data l’elevata specificità dell’ecografia per questo tipo di patologia, fa ritenere superflua l’esecuzione di ulteriori indagini diagnostiche. In casi di dubbia coledoco- 136 Mauro Maurantonio et al. espressione di rischio di sviluppare una neoplasia: “genetici” (per esempio gene del retinoblastoma, RB, cancro della mammella e cancro ereditario della mammella e dell’ovaio), oppure “metabolici” (rischio legato a fattori ambientali che inducono neoplasie sporadiche, vale a dire non legate esplicitamente a trasmissione ereditaria). Studi immunoistochimici e biochimici dimostrano che i marcatori oncologici sono espressi sia dal tessuto normale, sia da quello neoplastico, e che le differenze fra i due tipi di tessuto sono quantitative, essendo in linea di massima maggiore l’espressione e/o il rilascio del marcatore biologico da parte del tessuto neoplastico. In considerazione della specificità tissutale, schematicamente i marcatori oncologici possono essere classificati in: • biomarcatori ad elevata specificità d’organo (la tireoglobulina per la tiroide, il PSA per la prostata, la gonadotropina corionica umana per il sinciziotrofoblasto); • biomarcatori a prevalente espressione di un dato tipo cellulare (non strettamente organo-specifici) quali calcitonina (carcinoma midollare della tiroide, carcinoidi, tumori endocrini del tubo digerente, tumore a piccole cellule del polmone), NSE (tumore a piccole cellule del polmone, tumori neuroendocrini, neuroblastoma, tumore di Wilms, melanoma, linfomi, teratomi, timoma), cromogranina A, serotonina e metaboliti, catecolamine e metaboliti (tumori neuroendocrini); • biomarcatori associati in modo quantitativamente prevalente a dato tipo istologico, per esempio “squamous cell carcinoma associated antigen” e antigene polipeptidico tissutale (carcinomi di tipo squamoso), oppure CEA, CA 19.9, CA 125, CA 15.3 (adenocarcinomi). Per quanto concerne l’utilizzo clinico dei biomarcatori circolanti, è di scarsa utilità (salvo poche eccezioni quali il PSA o l’alfa-fetoproteina) l’impiego nello screening diagnostico dei soggetti asintomatici o a rischio di neoplasia, perché la bassa sensibilità e specificità non garantiscono accettabili valori di predittività. Nella fase diagnostica iniziale i biomarcatori possono essere utili, in associazione ad altre metodiche diagnostiche, in caso di metastasi a partenza ignota, nell’identificare l’istotipo della neoplasia e più raramente l’organo di partenza (ad esempio la prostata). Diversi marcatori, infatti, quali quelli mucinici, possono essere espressi da neoplasie a sede diversa in fase di metastasi. È il caso dei marcatori mucinici CA 19.9 (espresso dal carcinoma del colon, del pancreas, dello stomaco, dell’ovaio), CA 125 (carcinoma dell’ovaio, della mammella, del polmone, del pancreas, del colon), CA 15.3 (carcinoma della mammella, dell’ovaio, del pancreas, del polmone). Sempre nella fase di diagnosi i biomarcatori possono essere utili nella stadiazione ed assu- nel 5% dei casi)25. Sembra possedere maggiore specificità, sebbene minore sensibilità nel predire la natura neoplastica, rispetto all’ERCP26. L’EUS può essere utile per selezionare i pazienti con neoplasie resecabili, anche rispetto allo studio angiografico27. L’EUS sembra essere superiore alla tomografia computerizzata nell’identificazione e valutazione dell’invasione vascolare sia nelle neoplasie pancreatiche sia nei tumori periampullari28-30. L’USO CLINICO DEI MARCATORI ONCOLOGICI Gabriele Luppi L’utilizzo clinico dei marcatori oncologici31 rappresenta un capitolo, in oncologia, che non ha raggiunto ad oggi adeguati livelli di evidenza scientifica secondo i criteri dell’evidence-based medicine. Accanto ai marcatori oncologici tradizionali, indicatori della presenza e dell’estensione di una neoplasia, sono state identificate numerose sostanze associate a meccanismi molecolari strettamente connessi con caratteristiche genetiche o con meccanismi funzionali della neoplasia stessa. Per questi marcatori si prospettano nuovi ruoli come fattori prognostici o predittivi di risposta ad un trattamento, o come endpoint surrogati per la valutazione dell’efficacia di un trattamento. In generale, si definisce marcatore oncologico ogni segnale biologico circolante, espressione della presenza e/o estensione della malattia. La classificazione dei biomarcatori tumorali può essere basata sulle caratteristiche biochimiche-biologiche, sulla specificità per un determinato istotipo tumorale e, dal punto di vista operativo, sulla comune indicazione d’uso clinico. Si possono distinguere: • marcatori di cui si conosce la struttura chimica, quali enzimi (fosfatasi acida prostatica, enolasi neurone specifica-NSE, fosfatasi alcalina, latticodeidrogenasi, antigene prostatico specifico-PSA, ecc.), proteine tessuto-specifiche (tireoglobulina, cromogranina A), molecole di adesione (CEA), molecole di trasporto (alfa-fetoproteina), ormoni/subunità (gonadotropina corionica umana, catecolamine, adenocorticotropo), prodotti di differenziazione (ad esempio beta-microglobulina), altri tipi; • marcatori tipo mucine, identificati con anticorpi monoclonali (CA 19.9, CA 125, CA 15.3); • marcatori identificati come componenti della cellula tumorale (RNA del PSA, mutazione DNA del k-ras del gene p53, RNA dell’alfa-fetoproteina). Sempre in base alle caratteristiche biochimiche-biologiche, i marcatori oncologici possono essere biomarcatori di funzione (tra le più studiate, le proteine circolanti codificate da oncogeni e geni oncosoppressori) o, infine, 137 Ann Ital Med Int Vol 19, N 2 Aprile-Giugno 2004 mere in certi casi un valore prognostico. L’impiego più razionale e pratico, è tuttavia nel monitoraggio di determinate patologie neoplastiche, per valutare la risposta al trattamento o documentare le fasi di progressione o di recidiva della malattia. Dal punto di vista dell’utilità clinica, l’utilizzo dei marcatori oncologici dipende dall’obiettivo clinico per il quale essi sono richiesti. Il loro significato e la loro scelta può dipendere, infatti, dalla necessità di diagnosi differenziale di neoplasia dello stesso organo (per esempio l’NSE per il microcitoma del polmone), dalla loro indicazione sull’estensione della malattia o sulla prognosi (per esempio l’alfa-fetoproteina per l’epatocarcinoma), dalla capacità di fornire indicazioni circa la radicalità del trattamento del tumore primitivo (ad esempio calcitonina per il carcinoma midollare della tiroide; tireoglobulina per il carcinoma differenziato della tiroide), l’eventuale recidiva dopo trattamento o l’eventuale metastatizzazione (ad esempio CEA per il carcinoma del colon-retto, CA 19.9 per il carcinoma del pancreas e delle vie biliari). Da considerare inoltre le possibili false positività dei biomarcatori. Ad esempio un innalzamento del CA 19.9 è sempre da considerare con molta cautela poiché possono essere in causa numerose condizioni non neoplastiche quali pancreatiti, epatopatie, malattie infiammatorie intestinali o polmonari. Nello specifico della colestasi, il CA 19.9 non ha un ruolo determinante nella fase diagnostica, per la possibilità di false positività. In definitiva, nel sospetto di una neoplasia, occorre un’attenta valutazione dei marcatori nell’ambito del contesto clinico generale e dei reperti endoscopici e radiologici, e comunque la diagnosi di neoplasia dovrebbe essere confermata da una verifica istologica. prurito); 3) correggere la causa responsabile (farmaci immunosoppressori nelle forme autoimmunitarie o rimozione dell’ostacolo nell’ostruzione biliare extraepatica). In queste ultime forme l’opzione terapeutica è legata alla possibilità di una soluzione radicale dell’ostacolo o in mancanza, al ripristino di flusso della bile nel duodeno. Il monitoraggio ecografico e radiologico in corso di intervento chirurgico sulle vie biliari ha ridotto le complicazioni postchirurgiche e, inoltre, la radiologia ed endoscopia interventistica hanno, di fatto, azzerato l’occorrenza di ostruzione cronica delle vie biliari. Situazione quest’ultima che un tempo era responsabile della cirrosi biliare “secondaria”, oggi in pratica scomparsa. RADIOLOGIA ED ENDOSCOPIA INTERVENTISTICA Mario De Santis, Giampiero Rigo La radiologia interventistica svolge un ruolo essenziale nel trattamento delle sindromi biliari ostruttive. Permette il drenaggio percutaneo transepatico (colangiografia percutanea transepatica) biliare esterno, per risolvere rapidamente un ittero ingravescente, nell’attesa di intervento di elezione o in caso di colangiti ricorrenti insensibili a terapia antibiotica32,33. Nel caso di neoplasie non operabili che determinino colestasi ostruttiva, al drenaggio transcutaneo consegue il successivo impianto di endoprotesi di materiale plastico o metallico ricoperto da polimeri resistenti alla colonizzazione neoplastica. Nelle stenosi anastomotiche benigne, generalmente successive ad anastomosi bilio-digestive o a trapianto ortotopico di fegato, l’intervento indicato è la dilatazione pneumatica con cateteri a palloncino ad alte pressioni (bilioplastica), seguita da drenaggio protettivo della via biliare. Attualmente, all’ERCP diagnostica si associa spesso la sfinterotomia della papilla di Vater, trasformando l’ERCP da tecnica diagnostica a tecnica terapeutica. Prevede la visualizzazione endoscopica dell’ampolla di Vater, l’incannulamento del dotto comune biliare o del dotto pancreatico, e la successiva iniezione di mezzo di contrasto. Richiede la premedicazione con antibiotici attivi sui gram-negativi (ciprofloxacina, cefuroxime), oltre ad una sedazione con benzodiazepine34. Le indicazioni sono rappresentate da ittero ostruttivo ingravescente o che compromette la funzione epatica, nella coledocolitiasi e nelle stenosi delle vie biliari (colangite sclerosante primitiva, malattia di Caroli), in cui c’è anche la possibilità di posizionare stent o drenaggio naso-biliare o di eseguire biopsia o “brushing” delle vie biliari per analisi citologiche19,35. L’incidenza di complicazioni è del 2-3% con una mortalità dello 0.1-0.2%, dipendenti dall’esperienza dell’ope- IL TRATTAMENTO DELLA COLESTASI Mauro Maurantonio, Nicola Carulli Fuoriesce dai limiti della nostra trattazione una disanima della terapia delle sindromi colestatiche. Si sottolinea tuttavia come un intervento razionale debba considerare la certezza della diagnosi, le condizioni del paziente e, infine, la disponibilità ed esperienza locale delle varie procedure di intervento. In generale il trattamento della sindrome colestatica può considerare vari livelli di intervento volti a: 1) correggere gli effetti della mancanza di bile nell’intestino sui processi di digestione e assorbimento di grassi (somministrazione di vitamine liposolubili e trigliceridi a media catena); 2) ridurre gli eventi legati alla ritenzione nel fegato di acidi biliari in concentrazione tossica (somministrazione di acido ursodeossicolico e farmaci ad azione anti- 138 Mauro Maurantonio et al. BIBLIOGRAFIA ratore e dalla presenza di malattie pancreatiche o biliari sottostanti24. L’incremento delle amilasi con pancreatite acuta è la complicanza più comune; dipende dal volume e dalla pressione di iniezione del mezzo di contrasto36. Altra complicanza è rappresentata dalle colangiti, spesso causa di morte per shock settico, soprattutto in caso di infezioni biliari preesistenti. Una batteriemia è riportata in una percentuale che varia dallo 0 al 14%37. Controindicazioni all’ERCP sono rappresentate da colangite acuta, pancreatite acuta, pseudocisti pancreatica e sensibilità accertata ai mezzi di contrasto. Grave compromissione delle condizioni generali controindicano l’esecuzione dell’ERCP, analogamente a tutte le procedure di tipo invasivo, tranne nei casi di provata utilità della manovra. 01. La colestasi. Diagnosi e terapia basata sull’evidenza. Linee guida. A cura della Commissione “colestasi” dell’Associazione Italiana per lo Studio del Fegato. In: Documenti elaborati dalle Commissioni Scientifiche AISF (raccolta 1996-2001). 02. Carulli N, Bertolotti N, Carubbi F, Di Vincenzo A, Loria P. Inquadramento clinico delle sindromi colestatiche. In: Roda A, Roda E, Hofmann A, eds. Acidi biliari 2000, aggiornamento per il futuro. Milano: Edizioni Masson, 1999: 655-76. 03. Carulli N, Loria P, Bozzoli M, et al. La secrezione biliare e le sue alterazioni. In: Atti del 94° Congresso Nazionale della Società Italiana di Medicina Interna. Roma: Edizioni L. Pozzi, 1993: 218-70. 04. Bonnand AM, Heathcote EJ, Lindor KD, Poupon RE. Clinical significance of serum bilirubin levels under ursodeoxycholic acid therapy in patients with primary biliary cirrhosis. Hepatology 1999; 29: 39-43. 05. Beckett JI, Dewhurst N, Finlayson ND, Percy-Robb IW. Weightloss in primary biliary cirrhosis. Gut 1980; 21: 734-7. 06. Diamond TH, Stiel D, Lunzer M, McDowall D, Eckstein RP, Posen S. Hepatic osteodystrophy. Gastroenterology 1989; 96: 213-21. CONCLUSIONE 07. Borsch G, Wegener M, Wedmann B, et al. Clinical evaluation, ultrasound, core-scintigraphy in cholestasis. A prospective comparative clinical study. J Clin Gastroenterol 1988; 10: 185-90. Nicola Carulli Entrambi i casi clinici sono caratterizzati da analoga presentazione, con ittero improvviso senza dolore. In entrambi i casi, gli indici di colestasi e di citolisi epatica e l’elevazione del marcatore oncologico CA 19.9 richiedevano una pronta ed esatta diagnosi, tra le condizioni di colestasi ostruttiva. Tuttavia, in entrambi i casi hanno rischiato di fuorviare la diagnosi: nel primo caso descritto, gli esami strumentali ponevano il reale sospetto di neoplasia dell’ampolla di Vater (ampulloma) e il paziente sarebbe stato candidato a laparotomia per asportazione della neoformazione evidenziata in TAC spirale. Nel secondo caso clinico descritto, la notizia di una malattia a prognosi così infausta non era supportata da riscontri istologici precisi, alimentando così la speranza del paziente e dei familiari che alla base dell’ittero ostruttivo potesse esserci una pancreatite cronica con esito fibrotico-cicatriziale sulle vie biliari. La relativamente lunga sopravvivenza del paziente dalla diagnosi, in questo caso, confermava il dubbio. Un’attenta analisi dei dati clinici, tuttavia, sulla scorta delle conoscenze fisiopatologiche alla base del quadro clinico e bioumorale della colestasi poteva indirizzare la diagnosi e ricavare elementi prognostici accurati. In conclusione, l’ittero colestatico rappresenta una condizione spesso rapidamente evolutiva, di forte impatto emotivo conseguente alla colorazione itterica di cute e mucose. Sebbene l’utilizzo delle tecniche di imaging abbia ormai raggiunto livelli soddisfacenti di sensibilità e accuratezza, il loro uso razionale deve essere sempre preceduto da un’attenta valutazione clinica, volta da un lato a ridurre al minimo il disagio del paziente ed i costi dell’indagine, dall’altra ad operare una scelta che tenga conto della prognosi relativa alla causa responsabile. 08. Setchel KD, Street JM. Inborn errors of bile acid synthesis. Semin Liver Dis 1987; 7: 85-99. 09. Kullak-Ublick GA, Stieger B, Meier PJ. Enterohepatic bile salt transporter in normal physiology and liver disease. Gastroenterology 2004; 126: 322-42. 10. Soto JA, Barish MA, Yucel EK, Siegenberg D, Ferrucci JT, Chuttani R. Magnetic resonance cholangiography: comparison with endoscopic retrograde cholangiopancreatography. Gastroenterology 1996; 110: 589-97. 11. Holzknecht N, Gauger J, Sackmann M, et al. Breath-hold MR cholangiography with snapshot techniques: prospective comparison with endoscopic retrograde cholangiography. Radiology 1998; 206: 657-64. 12. Adamek HE, Albert J, Weitz M, Breer H, Schilling D, Riemann JF. A prospective evaluation of magnetic resonance cholangiopancreatography in patients with suspected bile duct obstruction. Gut 1998; 43: 680-3. 13. Fulcher AS, Turner MA, Capps GW, Zfass AM, Baker KM. Half-Fourier RARE MR cholangiopancreatography: experience in 300 subjects. Radiology 1998; 207: 21-32. 14. Yeh TS, Jan YY, Tseng JH, et al. Malignant perihilar biliary obstruction: magnetic resonance cholangiopancreatographic findings. Am J Gastroenterol 2000; 95: 432-40. 15. Zidi SH, Prat F, Le Guen O, Rondeau Y, Pelletier G. Performance characteristics of magnetic resonance cholangiography in the staging of malignant hilar strictures. Gut 2000; 46: 103-6. 16. Romagnuolo J, Barkun AJ, Joseph L, Reinhold C, Barkun JS. Which patients with suspected biliary obstruction are most likely to benefit from MRCP [abstract]? Gastroenterology 2000; 118 (Suppl 2): A-192. 17. Bret PM, Reinhold C. Magnetic resonance cholangio-pancreatography. Endoscopy 1997; 29: 472-86. 18. Rieger R, Wayand W. Yield of prospective, noninvasive evaluation of the common bile duct combined with selective ERCP/sphincterotomy in 1390 consecutive laparoscopic cholecystectomy patients. Gastrointest Endosc 1995; 42: 6-12. 19. NIH state-of-the-science statement on endoscopic retrograde cholangiopancreatography (ERCP) for diagnosis and therapy. NIH Consens State Sci Statements 2002; 19: 1-26. 20. Bilbao MK, Dotte CT, Lee TG, Katon RM. Complications of endoscopic retrograde cholangiopancreatography (ERCP): a study of 10 000 cases. Gastroenterology 1976; 70: 314-20. 139 Ann Ital Med Int Vol 19, N 2 Aprile-Giugno 2004 21. Soto JA, Yucel EK, Barish MA, Chuttani R, Ferrucci JT. MR cholangiopancreatography after unsuccessful or incomplete ERCP. Radiology 1996; 199: 91-8. and CT scanning for evaluation of pancreatic adenocarcinoma. Gastrointest Endosc 2000; 52: 367-71. 29. Erickson RA, Garza AA. Impact of endoscopic ultrasound on the management and outcome of pancreatic carcinoma. Am J Gastroenterol 2000; 95: 2248-54. 22. Pamos S, Benages A, Medina E, Martinez Sanjuan V. Prospective evaluation of magnetic resonance cholangiopancreatography in patients with biliary disease: comparative study with conventional ultrasonography and endoscopic retrograde cholangiopancreatography. Diagnostic algoritm. Dig Liver Dis 2003; 35: 186-92. 30. Shoup M, Hodul P, Aranha GV, et al. Defining a role for endoscopic ultrasound in staging periampullary tumors. Am J Gastroenterol 2000; 95: 1708-13. 23. Arslan A, Geitung JT, Viktil E, Abdelnoor M, Osnes M. Pancreaticobiliary diseases. Comparison of 2D single-shot turbo spin-echo MR cholangio-pancreatography with endoscopic retrograde cholangio-pancreatography. Acta Radiol 2000; 41: 621-6. 31. Gion M. Guida all’uso clinico dei biomarcatori in oncologia 2002. Vol 11. Milano: Edizioni Biomedia, ristampa luglio 2003. 24. Thornton J, Axon A. Towards safer endoscopic retrograde cholangiopancreatography. Gut 1993; 34: 721-4. 33. Lameris JS, Obertop H, Jeekel J. Biliary drainage by ultrasound-guided puncture of the left hepatic duct. Clin Radiol 1985; 36: 269-74. 32. Lai EC, Mok FP, Tan ES, et al. Endoscopic biliary drainage for severe acute cholangitis. N Engl J Med 1992; 326: 1582-6. 25. Voss M, Hammel P, Molas G, et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut 2000; 46: 244-9. 34. Mehal WZ, Culshaw KD, Tillotson GS, Chapman RW. Antibiotic prophylaxis for ERCP: a randomised clinical trial comparing ciprofloxacin and cefuroxime in 200 patients at high risk of cholangitis. Eur J Gastroenterol Hepatol 1995; 7: 841-5. 26. Glasbrenner B, Schwarz M, Pauls S, Preclik G, Beger HG, Adler G. Prospective comparison of endoscopic ultrasound and endoscopic retrograde cholangiopancreatography in the preoperative assessment of masses in pancreatic head. Dig Surg 2000; 17: 468-74. 35. Kurzawinski TR, Deery A, Dooley JS, Dick R, Hobbs KE, Davidson BR. A prospective study of biliary cytology in 100 patients with bile duct strictures. Hepatology 1993; 18: 1399403. 27. Tierney WM, Fendrick AM, Hirth RA, Scheinam JM. The clinical and economic impact of alternative strategies for adenocarcinoma of the pancreas. Am J Gastroenterol 2000; 95: 170813. 36. Lehman GA. Contrast media in ERCP. Gastrointest Endosc 1988; 34: 295. 37. Shorvon PJ, Eykyn SJ, Cotton PB. Gastrointestinal instrumentation, bacteraemia, and endocarditis. Gut 1983; 24: 1078-93. 28. Mertz HR, Sechopoulos P, Delbeke D, Laeach SD. EUS, PET Per la corrispondenza: Prof. Nicola Carulli, Dipartimento di Medicine e Specialità Mediche, Struttura Complessa di Medicina 3, Azienda Ospedaliera-Universitaria, Via del Pozzo 71, 41100 Modena. E-mail: [email protected] 140 Mauro Maurantonio et al. QUESTIONARIO PRE E POST-LETTURA DEL CASO 1. Dovendo utilizzare uno solo dei seguenti indicatori per la diagnosi di colestasi, quale utilizzeresti? a) Bilirubinemia b) Bileacidemia c) Transaminasemia d) Fosfatasemia alcalina + gamma-glutamiltranspeptidasi 2. La comparsa di ipertransaminasemia in corso di colestasi è causata da: a) Ritenzione di sali biliari b) Ritenzione di bilirubina c) Ritenzione di colesterolo 3. In soggetti con ostruzione delle vie biliari extraepatiche, l’aumento delle transaminasi è un segno importante di: a) Entità dell’ostruzione b) Rapidità con cui l’ostruzione si è verificata c) Natura dell’ostruzione 4. La causa più frequente di ostruzione biliare extraepatica nell’adulto è rappresentata da: a) Litiasi b) Neoplasia del pancreas c) Stenosi postchirurgica 5. Scegliete, tra le seguenti, la procedura diagnostica più corretta dopo esame clinico, in caso di sospetta coledocolitiasi: a) Ecografia + tomografia assiale computerizzata b) Ecografia + colangiopancreatografia retrograda endoscopica c) Ecografia endoscopica 6. La sensibilità/specificità della colangiopancreatografia in risonanza magnetica nelle colestasi intraepatiche: a) Dipende dalle condizioni del paziente b) È sovrapponibile alla colangiopancreatografia retrograda endoscopica c) È migliore della colangiopancreatografia retrograda endoscopica 7. La sensibilità/specificità dell’ultrasonografia, nella coledocolitiasi: a) Permette di non procedere con ulteriori indagini diagnostiche, tranne nei casi dubbi b) Necessita sempre di conferma diagnostica con colangiopancreatografia retrograda endoscopica c) Necessita sempre di conferma diagnostica con ecoendoscopia 141 Ann Ital Med Int Vol 19, N 2 Aprile-Giugno 2004 SEGUE QUESTIONARIO PRE E POST-LETTURA DEL CASO 8. L’utilizzo del marcatore oncologico CA 19.9 nel sospetto della natura neoplastica dell’ostruzione biliare: a) È sempre diagnostico b) Può essere utile nel follow-up postchirurgico c) Non ha alcuna utilità 9. Il trattamento di elezione per un ittero rapidamente ingravescente è: a) Drenaggio transepatico percutaneo b) Acido ursodesossicolico a dosi almeno pari a 15 mg/kg/die c) Dipende dall’eziologia dell’ittero 10. La colangiopancreatografia retrograda endoscopica è: a) Metodica con finalità diagnostico-terapeutica b) Metodica sempre sostituibile con colangiopancreatografia in risonanza magnetica c) Metodica senza rischio di complicanze 11. Le principali controindicazioni alla colangiopancreatografia retrograda endoscopica sono rappresentate da: a) Colangite acuta, pancreatite acuta, agitazione psicomotoria b) Setticemia, ipossiemia, stato di shock c) Pseudocisti pancreatica, allergia ai mezzi di contrasto d) Tutte le precedenti 12. Il monitoraggio del paziente dopo papillosfinterotomia in colangiopancreatografia retrograda endoscopica prevede: a) Esami bioumorali comprendenti emocromo, amilasi, lipasi, indici di colestasi e epatocitolisi b) Terapia antibiotica con ciprofloxacina o cefuroxime c) Digiuno per almeno 24 ore d) Tutte le precedenti 142 RISPOSTE AL QUESTIONARIO PUBBLICATO SUL FASCICOLO 1-2004 1. Quale fra i seguenti sintomi/segni è il più frequente nella presentazione clinica di malattia celiaca? R Anemia 2. La celiachia è di più comune riscontro nei pazienti affetti da: (si possono segnare più risposte) R Sindrome di Down R Tiroidite autoimmune 3. Il test più specifico per la diagnosi di celiachia è: R Anticorpi antiendomisio IgA 4. La biopsia intestinale deve essere ripetuta dopo 1 anno di dieta, in caso di: R Negatività degli anticorpi al momento della diagnosi 5. Quali tra queste sono complicanze della celiachia? (anche più di una) R Digiuno-ileite ulcerativa R Carcinoma duodenale 6. Quale fra le seguenti affermazioni è vera? R L’osteoporosi del celiaco può necessitare di trattamento con vitamina D 7. Quale fra questi fattori è maggiormente importante nel determinare l’anemia? R Deficit di ferro 8. L’ipertransaminasemia del celiaco è solitamente caratterizzata da: R Normalizzazione entro 6 mesi dall’inizio della dieta priva di glutine 9. Falsi positivi di antitransglutaminasi si possono osservare più di frequente in pazienti con: R Epatopatia cronica 10. La biopsia intestinale del celiaco è: R Con quadri differenti in diverse sedi intestinali 11. Quale fra questi alimenti è assolutamente sicuro nella dieta del celiaco? R Riso 12. Quale fra le seguenti affermazioni a proposito della terapia nei 3 mesi successivi alla diagnosi è corretta? R I preparati con enzimi pancreatici possono essere utili
Scaricare