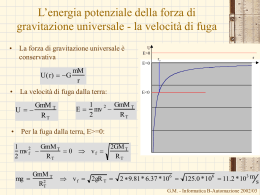
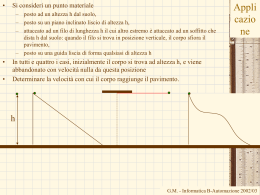
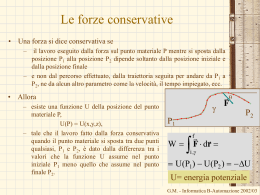
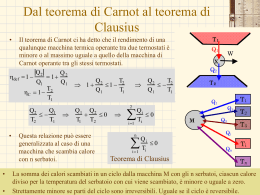
Il lavoro in termodinamica • • • • • Il lavoro rappresenta uno dei modi con cui, durante una trasformazione il sistema e l’ambiente circostante si scambiano energia. In termodinamica viene considerato positivo il lavoro fatto dal sistema sull’ambiente circostante Nel dare la definizione di lavoro fatto dal sistema dobbiamo far riferimento al lavoro fatto dall’ambiente sul sistema Il lavoro fatto dal sistema è l’opposto del lavoro fatto dall’ambiente sul sistema W=-West Il motivo di questa scelta è semplice: Fe= PatmS + Mg (S superficie del pistone) Patm M Fe – quando il sistema subisce una trasformazione non reversibile, • poiché non si conoscono gli stati intermedi del sistema durante la trasformazione • non è possibile determinare le forze esercitate dal sistema sull’ambiente esterno e quindi il lavoro effettuato dal sistema – Mentre, in generale, è possibile determinare le forze esercitate dall’ambiente esterno sul sistema (quelle esercitate dal sistema saranno uguali ed opposte). – È chiaro che in caso di trasformazioni reversibili converrà usare le coordinate termodinamiche del sistema G.M. - Informatica B-Automazione 2002/03 Il lavoro in termodinamica • • • • • • • • • • Fe= PatmS + Mg Facendo riferimento alla figura, il lavoro esterno sarà dato da: West=-Fel (S superficie del pistone) Il segno meno indica che forza e spostamento sono discordi M Il lavoro fatto dal sistema sarà allora Patm W=-West= Fel La forza esercitata dall’ambiente esterno può essere derivata dalla pressione esterna: Fe Fe=PeS Dove S è l’area del pistone. Si ottiene W= Fel= PeSl= PeV In cui V è la variazione di volume subita dal gas Naturalmente, se la trasformazione è reversibile, e quindi è quasi statica, la pressione esterne deve essere uguale a quella interna (equilibrio meccanico) Il lavoro diventa W= PV Se la trasformazione è reversibile allora possiamo suddividerla in tratti infinitesimi. Il lavoro in ciascun tratto sarà dato da: dW= PdV G.M. - Informatica B-Automazione 2002/03 Il lavoro su una trasformazione reversibile W = area sotto la I • P Per una trasformazione reversibile tra gli stati i ed f – Il lavoro infinitesimo – Il lavoro complessivo: W trasformazione i dW=PdV (zona in verde) P f f PdV i • V V+dV Corrisponde all’aria sotto la trasformazione – Nel caso di una espansione (Vf>Vi) il lavoro è positivo – Nel caso di una compressione (Vf<Vi) il lavoro è negativo – Percorrendo al contrario la trasformazione reversibile, da f a i,P il lavoro cambia di segno. • Il lavoro dipende dalla trasformazione che connette lo stato iniziale e lo stato finale V WI = area sotto la trasformazione i f V G.M. - Informatica B-Automazione 2002/03 Il lavoro dipende dalla trasformazione W1 f PdV i C f PdV Pf dV PdV i C P i f C Pi D 0 isocora dV=0 Pf Vfc Pf Vf Vi Pf f C Vc Vi W2 i f PdV D PdV i f D Pi dV PdV D 0 isocora dV=0 i Pi VDi Pi Vf Vi VD Vf W3 Area sotto la trasformazione • = W1 + Vi • • • 1 2 3 Vf V iCf iDf if 1 Pi Pf Vf Vi 2 Il lavoro dW=PdV – Non è un differenziale esatto – Non esiste una funzione delle coordinate tale che il lavoro può essere espresso come differenza dei valori assunti da questa funzione nello stato finale e in quello iniziale G.M. - Informatica B-Automazione 2002/03 Il lavoro adiabatico • • Se però si effettua una trasformazione adiabatica In qualunque modo viene effettuata la trasformazione – più lentamente o più rapidamente, – per una parte del tempo azionando il mulinello, e per la restante il generatore – Invertendo i due processi • • • Il lavoro effettuato non dipende dalla particolare trasformazione ma solo dallo stato iniziale e da quelli finale Quindi Esiste una funzione dello stato del sistema, U(P,V), tale che: U U W i • f adiab M M Generatore senza perdite Mulinello • Sistema termodinamico: – Acqua alla pressione atmosferica alla temperatura Ti • Trasformazione: – Trasformazione adiabatica che porta il sistema sempre alla pressione atmosferica ma ad una temperatura più elevata, Tf. La funzione U(P,V) è detta energia interna U U f Ui Wadiab Esprime la conservazione dell’energia G.M. - Informatica B-Automazione 2002/03 La funzione energia interna • L’osservazione fatta sul lavoro adiabatico ci dice che esiste una funzione di stato, l’energia interna: U(P,V) U(V,T) U(P,T) – Solo due coordinate sono sufficienti per individuare uno stato di equilibrio termodinamico • La variazione dell’energia interna non dipende dalla particolare trasformazione subita dal sistema termodinamico, reversibile, irreversibile, adiabatica, non adiabatica, senza scambi di lavoro ma solo dallo stato iniziale e dallo stato finale • Per una trasformazione infinitesima la variazione di energia interna sarà data da dU=-dWadiab dU è un differenziale esatto • – Esiste la funzione U tale che la variazione dell’energia interna è data dalla differenza di valori assunti dalla funzione nel punto finale meno quello del punto iniziale • Anche il lavoro adiabatico, dWadiab, è un differenziale esatto. G.M. - Informatica B-Automazione 2002/03 Il I principio della termodinamica • Io posso realizzare la stessa trasformazione – l’innalzamento di temperatura di una certa quantità d’acqua alla pressione atmosferica • • • senza compiere lavoro adiabatico, o addirittura senza compiere lavoro per esempio, posso utilizzare un serbatoio di calore La variazione di energia interna è la stessa che avevo prima – Lo stato iniziale e finale coincidono – Non è stato compiuto alcun lavoro – Ma è stato trasferito del calore a causa delle differenze di temperatura tra il sistema e l’ambiente esterno • • • – Eseguito lavoro – Scambiato calore Per continuare a conservare l’energia U=Q La variazione di energia interna è uguale al calore scambiato con l’ambiente esterno – I segni del calore sono opposti a quelli del lavoro In generale se nella trasformazione viene U=Q-W • I principio della G.M. - Informatica B-Automazione 2002/03 termodinamica Il I principio della termodinamica U=Q-W • Esprime l’esistenza della funzione energia interna del sistema che è una funzione dello stato del sistema; • Esprime la conservazione dell’energia • Stabilisce che il calore è una forma di energia, – è l'energia scambiata tra il sistema e l'ambiente circostante a causa di una differenza di temperatura. – In altri termini è l'energia che transita attraverso i confini del sistema a causa di una differenza di temperatura tra il sistema e l'ambiente circostante. – Essendo il calore un’energia, nel Sistema Internazionale di Unità di Misura si misura in Joule. • Il primo principio si applica a tutte le trasformazioni, sia a quelle reversibili che a quelle irreversibili G.M. - Informatica B-Automazione 2002/03 L’equivalente meccanico del calore • • • • Abbiamo definito la caloria come la quantità di calore necessaria per innalzare la temperatura di un grammo di acqua da 14.5°C a 15.5°C alla pressione atmosferica. Lo stesso cambiamento di stato si ottiene anche effettuando solo del lavoro adiabatico Joule esegui una seria di esperimenti come quello mostrato in figura con cui determinò L’equivalente meccanico del calore, ossia la relazione tra la caloria e l’unità di misura del lavoro,J. M Mulinello 1 caloria = 4.1858 J G.M. - Informatica B-Automazione 2002/03 Il calore dipende dalla trasformazione • • • • Il primo principio stabilisce che U=Q-W U non dipende dalla trasformazione W dipende dalla trasformazione (dW non è un differenziale esatto, dW ) Anche Q dipende dalla trasformazione (dQ non è un differenziale esatto, dQ) • Per una trasformazione infinitesima dU= dQ - dW • Esistono due eccezioni – Le trasformazioni a lavoro nullo (a volume costante) – Le trasformazioni a pressione costante • per queste trasformazioni il calore è una funzione di stato, dipende solo dallo stato iniziale e da quello finale. G.M. - Informatica B-Automazione 2002/03 Il calore nelle trasformazioni a volume costante • Il lavoro può essere valutato utilizzando i parametri dell’ambiente esterno sia per una trasformazione reversibile che per una irreversibile. W=Pe(Vf-Vi) • Ma Vf=Vi • Allora (volume costante) U=Q W=0 (lavoro nullo) (per una trasformazione infinitesima dQ= dU) – il calore scambiato nella trasformazione a volume costante è uguale alla variazione di energia interna – Poiché l’energia interna è una funzione di stato, • Anche il calore in questo caso è una funzione di stato • Conseguenza – Il calore scambiato in una trasformazione a volume costante (lavoro nullo) dipende solo dallo stato iniziale e da quello finale e non dipende dalla particolare trasformazione – Il calore scambiati sulla trasformazione irreversibile è uguale a quello scambiato sulla trasformazione reversibile. G.M. - Informatica B-Automazione 2002/03 Il calore nelle trasformazioni a pressione costante • • • Anche in questo caso il lavoro può essere valutato utilizzando i parametri dell’ambiente esterno sia per una trasformazione reversibile che per una irreversibile. W=Pe(Vf-Vi)= PfVf-PiVi Essendo Pf=Pi=Pe Per il I principio della termodinamica U=Q-W Q= U+W= U+ PfVf-PiVi=Uf-Ui + PfVf-PiVi=(Uf + PfVf)-(Ui + PiVi) • La grandezza H= U + PV • • è una funzione di stato (entalpia) Q= H Anche in questo caso il calore scambiato è una funzione di stato. È lo stesso sia per una trasformazione reversibile che per una irreversibile • Per una trasformazione infinitesima dQ= dH G.M. - Informatica B-Automazione 2002/03 I calori specifici a volume e pressione costante • Tornando alla definizione di calore specifico Calore specifico a volume costante c 1 dQ 1 dU m dT m dT V cos t Calore specifico a pressione costante c • • 1 dQ 1 dH m dT m dT Pcos t Calore molare a volume costante CV 1 dQ 1 dU n dT n dT V cos t Calore molare a pressione costante CP 1 dQ 1 dH n dT n dT P cost Appare che è possibile esprimere i calori specifici a volume e pressione costante in termini delle funzioni di stato U e H, Non dipendono dalla trasformazione (purché a volume o a pressione costante) – La trasformazione potrà essere reversibile o irreversibile il risultato è identico. G.M. - Informatica B-Automazione 2002/03 Il gas perfetto • I gas – Monoatomici (i gas nobili: He,Ne, Ar, Kr, Xe) – Biatomici (H2, O2, N2) – Poliatomici (C O2, H2O,…) • • Si comportano come gas perfetto in condizione di bassa densità Un gas perfetto è un gas che in ogni condizioni soddisfa l’equazione di stato di un gas perfetto PV=nRT R 0.08205 • • Legge di Boyle PV=cost a T=cost Legge di Charles, Gay-Lussac: V1=Vo(1+btC) b coefficiente di dilatazione di volume 1/273.15 per tutti i gas (in condizioni di gas perfetto) • Legge di Avogadro: volumi uguali di gas nelle stesse condizioni di pressione e temperatura contengono lo stesso numero di molecole. litri atm joule cal 8.314 1.986 mole K mole K mole K G.M. - Informatica B-Automazione 2002/03 L’energia interna del gas perfetto • • L’espansione libera La trasformazione è irreversibile – Non c’è equilibrio meccanico – La pressione è diversa nei due contenitori • • • Vuoto Gas Pe fig. A Per calcolare il lavoro dobbiamo usare i parametri dell’ambiente: W=PeV V è la variazione del volume su cui agisce la pressione esterna (=0 contenitore con pareti rigide) Temperatura iniziale = Facendo avvenire l’espansione in un calorimetro – Se il gas si comporta come un gas perfetto • • • Ti=Tf Il calore scambiato con il calorimetro è nullo (Q=Cap_terT) U=Q-W=0 U(T,V1)=U(T,V2) U non dipende da V ma solo da T. Temperatura finale = G.M. - Informatica B-Automazione 2002/03
Scaricare