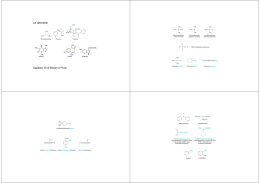
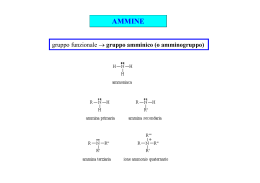
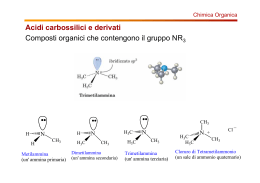
AMMINE R-NH2 R2-NH R3-N Ammina Primaria Ammina Secondaria Ammina Terziaria Nomenclatura: ← 2-METIL-PROPANAMMINA 2-BUTANAMMINA → ← N-METIL PROPANAMMINA N-ETIL-N-METIL BENZAMMINA ← N,N DIMETIL BENZAMMINA FENIL METANAMMINA → (BENZILAMMINA) Nella nomenclatura IUPAC si usa il nome dell'alcano seguito dal suffisso -ammina. Nella nomenclatura TRADIZIONALE si usa il nome del radicale. Le ammine possono esistere come enantiomeri ma la loro interconversione è così veloce che non si è in grado di separarli. Confronti dello stato fisico a temperatura ambiente: CH3OH → Liquido CH3NH2 → Gassoso CH3CH2OH → Liquido CH3CH2NH2 → Gassoso Comportamento in Acqua R-NH2 + H2O ←→ R-NH3+ + OHR-NH3+ + H2O ←→ R-NH2 + H3O+ pKb ~ 4 pKa ~ 10 R-NH2 pKa ~ 10 è più basica dell'ammoniaca (pKa ~ 9) perchè la carica positiva risultante dalla dissociazione in acqua è stabilizzata dal gruppo R. Le ammine secondarie sono ancora più basiche rispetto alle primarie. Le ammine terziarie sono MENO basiche perchè l'aggiunta dell'idrogeno blocca la possibilità dei gruppi R di spostarsi e quindi si “danno fastidio” stericamente tra loro. L'anilina è ancora meno basica perchè protonando il gruppo si blocca la risonanza che stabilizzava l'anello come mostrato. Non potendo risuonare il doppietto fa si che l'anilina sia la mano basica di tutte. Facendo una scala si ha: Più Basica → Meno Basica R2-NH > R-NH2 > R3-N > Ar-NH2 Le ammine in acqua possono formare anioni ma la loro pKa è irrilevante nei confronti dell'acqua. In particolari condizioni posso formare anioni stabili e forti che possono essere usati in reazioni. R-NH2 + H2O ← → R-NH- + H3O+ pKa ~ 34 (valore non rilevabile) R-NH2 + BuLi → R-NH- Li+ + Butano La LDA (Litio Diisopropil Ammide) è una base fortissima e poco nucleofila usata per le eliminazioni e le deprotonazioni. PREPARAZIONE DELLE AMMINE • SOSTITUZIONE CON ALOGENI ALCHILICI La reazione è poco controllabile e si possono ottenere la specie monosostituita utilizzando poco ioduro di metile, oppure, ottenere lo ione aggiungendo poca ammoniaca. N.B.:Lo ione Cianuro è molto tossico! N.B.: Lo ione N3- è potenzialmente esplosivo! • REAZIONE DI GABRIEL La reazione utilizza Potassio Ftalammide che reagisce formando l'ammina e acido ftalico. Questa reazione è utilizzata per la produzione di amminoacidi partendo da acidi alfa alogenidrici. • AMMINAZIONE RIDUTTIVA • ESCHWEILER – CLARKE • DEGRADAZIONE DI HOFFMAN Se R ha uno stereocentro dopo la reazione viene mantenuto. • REAZIONE DI MANNICH • ELIMINAZIONE DI HOFFMANN • SAGGIO DI HINSBER Ammina + Ph-SO2Cl + NaOH → A + HCl → B Primaria Soluzione Precipita Secondaria Precipita Precipita Terziaria Divisione in 2 fasi Soluzione
Scaricare