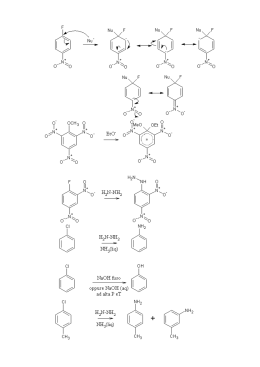
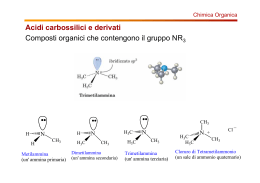
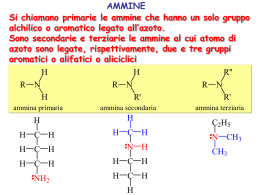
Ammine Classificazione • Le ammine sono derivati dell’ammoniaca in cui uno o più idrogeni è stato sostituito da un alchile o un arile. • Sono le basi più forti presenti negli organismi viventi in ammino acidi, peptidi, proteine, basi eterocicliche degli acidi nucleici, alcaloidi, etc. e sono catalizzatori di importanti reazioni biologiche. R' NH3 ammoniaca RNH2 1o R NH R' 2o R N R '' 3o R' R N R'' R''' ione tetraalchilammonio quaternario Classificazione • Le ammine vengono suddivise in: • ammine alifatiche: ammine nelle quali l’azoto è legato solo H3C a gruppi alchilici benzildimetilammina ammina 3° N CH3 CH2 • ammine aromatiche: ammine nelle quali l’azoto è legato ad uno o più gruppi arilici N-metilanilina ammina 2° aromatica CH3 NH • ammine eterocicliche: ammine nelle quali l’azoto è inserito in un anello aromatico o alifatico N N H piridina pirrolo N H piperidina N H pirrolidina Chiralità delle ammine L’azoto può avere 3 gruppi differenti e 1 lone pair, e l’ammina è chirale, ma gli enantiomeri non possono essere separati a causa dell’inversione dell’N. ‡ (R)-etilmetilammina stato di transizione (S)-etilmetilammina Se l’azoto è impedito nella rotazione gli enantiomeri sono separabili. (R)-1,2,2-trimetilaziridina (S)-1,2,2-trimetilaziridina Inversione dell’azoto La barriera dell’inversione è molto bassa: le ammine non sono separabili. R R orbitale sp2 N R ~6 kcal/mole orbitale sp3 R R R N R R R N I sali di ammonio quaternario sono separabili. orbitale sp3 Alcaloidi NH2 NH2 HO OH anfetamina dopamina (trasmissione nervosa) CH3O OH NHCH3 NH2 CH3O OCH3 efedrina (adrenalina) mescalina O O N O O NHCH3 metilenediossimetanfetamina (MDMA, “ecstasy”) NH2 novocaina Composti Azotati NH2 HO N H O HO H3C O N H Coniina H3C O N Muscarina OCH3 H H3C Ph Atropina S Cl N H3C OH N Chinino OH O HO N N N N CH3 O NH2 N OH H3C N N CH3 Nicotina H N Caffeina Serotonina CH3 N Cl CH3 H3C CH3 N tiamina Vit B1 N O HO Morfina CH3 Nomenclatura IUPAC: alcanammina come gruppo: H2N– ammino RNH – (N-alchilammino) (N,N-dialchilammino) R2N – Comune: alchilammina, alchilalchil'ammina, dialchilammina, etc. NH 2 1-amminobutano butanammina n-butilammina H N CH 3 1-metilamminopropano N-metilpropanammina metilpropilammina NH 2 2-amino-2-metilpropano 2-metil-2-propanammina tert-butilammina N dimetilamminoetano N,N-dimetiletanammina etildimetilammina Nomenclatura Ammine eterocicliche NH2 N N H indolo anilina N N H N piridina piperidina pirimidina N N H N H N H pirrolo pirrolidina imidazolo Proprietà fisiche • Le amine sono composti moderatamente polari • legami idrogeno N–H----N sono più deboli di O–H----O (differenza in elettronegatività tra N e H (3.0 – 2.1 = 0.9) è < di quella tra O e H (3.5 – 2.1 = 1.4)) N H R H sp3 trigonale piramidale PM p.eb., °C CH3CH3 CH3NH2 CH3OH 30.1 31.1 32.0 –88.6 < –6.3 NH2 p.eb., °C 48 Sono solubili in acqua. < 65.0 NH < 34 N < 3 Solubilità e odore • Ammine corte (<6 C) sono solubili in acqua. • Tutte le ammine sono accettori di legame idrogeno da acqua e alcoli. • La ramificazione aumenta la solubilità. • La maggior parte delle ammine puzzano di pesce in putrefazione. H2N H2N NH2 NH2 putrescina 1,4-butandiammina cadaverina 1,5-pentandiammina nella carne in putrefazione 11 Sintesi di Ammine 1. Alchilazione diretta per l’ottenimento di ammine 1° 2. Sintesi di Gabriel di ammine 1° 3. Riduzione: – – – – 4. 5. 6. 7. di azidi di nitrili di ammidi di ossime Aminazione riduttiva di aldeidi o chetoni Riduzione di nitrocomposti aromatici Riarrangiamento di Hofmann Riarrangiamento di Curtius 12 Sintesi di Ammine 1. Alchilazione diretta – ammine 1° • Le ammine reagiscono con gli alogenuri 1° con meccanismo SN2. • Problema: polialchilazione: si formano miscele di prodotti mono-, di-, and tri-alchilati e infine sali di tetralchilammonio. NH3 Nu B Nu B RX RNH2 RX R2NH RX R 3N NH3 + RX → RNH3+ + X– NH3 + RNH3+X– ' RNH2 + NH4+X– RNH2 + RX → R2NH2+ + X– RX R4N+X– La reazione dovrebbe fermarsi qui NH3 + R2NH2+ X– ' R2NH + NH4+X– etc. etc. • L’alchilazione non può essere controllata! • Per fare un’ammina 1° si usa un largo eccesso (10:1) di ammoniaca con un alogenuro 1° o un tosilato 1° (SN2). 13 Sintesi di Ammine 2. Sintesi di Gabriel di ammine 1° • Si usa l’anione ftalimide come una forma di ammoniaca che può essere alchilata un sola volta. • Il substrato RX deve essere adatto a SN2, poi si scalda con idrazina. O O NH _ N K+ KOH O O ftalimmide pKa 9 ftalimmide potassica Limiti della reazione: 1) RX solo 1° e 2° 2) produce solo ammine 1° N non ulteriormente alchilabile O R–X N R O KOH H2O R–NH2 + acido ftalico NH2–NH2 idrazina calore O NH NH O + R–NH2 Sintesi di Gabriel Meccanismo O N-R NH2NH2 HO NHNH 2 O NHNH2 NHR N-R O O O O NH NH RNH2 + O O NH NH O NHR ftalazina 1,4-dione 15 Sintesi di Gabriel Esempi O O NK H2NNH2 O Br N O Br NK O NH2 O O N O NH2 H2NNH2 NH2 16 Sintesi di Ammine 3a. Riduzione di azidi • L’azide è un buon nucleofilo. Reagisce con alogenuri o tosilati 1° e 2° non ingombrati (SN2). Alchil azidi sono esplosivi! Non si isolano. R–X + N3– → R–N3 + X– • L’azide viene ridotta con LiAlH4 o con H2/Pt, Pd o Ni R–N3 + LiAlH4 Br NaN3 H3O+ → → R–NH2 N3 1) LiAlH4 2) H2O NH2 17 Sintesi di Ammine 3b. Riduzione di nitrili • Il cianuro –C≡N è un buon nucleofilo per SN2. • La riduzione del nitrile con H2/cat o LiAlH4 fornisce il gruppo –CH2NH2 (1 C in più rispetto alla catena originaria) R X Br NaCN DMSO NaCN R C≡N CN H2 cat. 1) LiAlH4 2) H 2O RCH2NH2 CH2NH 2 Sintesi di Ammine 3c. Riduzione di ammidi • Un cloruro di un acido reagisce con ammoniaca, un’ammina 1° o 2° per dare un’ammide. • Il C=O dell’ammide viene ridotto a CH2 con LiAlH4. – ammoniaca dà un’ammina 1°: O NH3 O 1) LiAlH4 NH2 Cl 2) H3O+ NH2 – un’ammina 1° dà un’ammina 2°: O O CH3CH2NH2 1) LiAlH4 N H Cl + 2) H3O N H – un’ammina 2° dà un’ammina 3°: O O Cl (CH3)2NH N(CH3)2 1) LiAlH4 N(CH3)2 2) H3O+ 19 Sintesi di Ammine 3d. Riduzione di ossime O NH2OH N OH H2/Ni NH2 H+ 20 Sintesi di Ammine 4. Aminazione riduttiva di aldeidi o chetoni • È una interessante reazione che ha il suo equivalente biologico nella biosintesi degli ammino acidi. • Si fa reagire un’aldeide o un chetone in presenza di un agente riducente (H2/Ni, sodio cianoboroidruro Na(CN)3BH3, litio cianoboroidruro Li(CN)3BH3, sodio acetatoboroidruro Na(Ac)3BH) con: 1. ammoniaca: si ottiene un’ammina primaria 2. un’ammina primaria: si ottiene un’ammina secondaria 3. un’ammina secondaria: si ottiene un’ammina terziaria 21 Sintesi di Ammine 4. Aminazione riduttiva di aldeidi o chetoni 1) NH3 O 1) LiAlH4 NH 2) H3O+ H+ ammina 1° immina CH3 NH 2 O N CH3 1) LiAlH4 immina H 3C O 3) (CH 3 )2NH H H+ HN CH3 2) H3O+ H+ 2) NH2 ammina 2° N CH 3 H3C Na(CH3 COO)3BH H sale di imminio N CH 3 COOH 22 CH 3 Sintesi di Ammine 5. Riduzione di nitrocomposti aromatici • È un metodo usato comunemente per sintetizzare aniline. • –NO2 può essere ridotto a –NH2 in diverse condizioni: – un idruro e un acido di Lewis (NaBH4 + NiCl2) – un metallo attivo in soluzione acida (Fe/AcOH o HCl, Sn/HCl, Zn/AcOH (Clemmensen)) – per idrogenazione catalitica in fase eterogenea (PtO2) o omogenea (RuCl2(PPh3)3). CH3 CH3 Zn, HCl EtOH NO2 O NH2 o NaBH4/NiCl2 NO2 O Fe/AcOH NH2 il CO non si riduce Sintesi di Ammine 6. Riarrangiamento di Hofmann di ammidi 1° ad ammine 1° 7. Riarrangiamento di Curtius di acil azidi ad ammine 1° • Hanno meccanismo simile ma differenti condizioni. – Hofmann O R C NH 2 X2, OHH 2O RNH 2 – Curtius O R C N3− Cl O C N3 R acil azide ∆ R–N=C=O H 2O RNH 2 + CO2 alchil isocianato 24 Riarrangiamento di Hofmann In presenza di una base forte, le ammidi primarie reagiscono con cloro o bromo per formare ammine con un atomo di carbonio in meno. O R HO – N H H R H N – Br–Br O R O O N H R N– Br R–N=C=O N + Br- – estrazione di un protone N-H Br N-Bromoammide O –OH Br –OH R H HO C R N O– R–N=C=O isocianato HO C O R N – H–O–H –O C O R N H H–O–H –CO2 H R N H – estrazione di un protone N-H – riarrangiamento a isocianato –Isocianato reagisce con H2O per dare acido carbammico che perde CO2 C C : O N=N=N: : R O R : : Riarrangiamento di Curtius N−N≡N: ∆ R–N=C=O + H 2O RNH 2 + CO2 :N≡N: 26 Reattività delle Ammine 27 Basicità • Il lone pair di elettroni può accettare un protone da un acido. • Ammoniaca ha pKa = 9.26. Le alchil ammine sono di solito basi più forti dell’ammoniaca (pKa 9.8 – 11). • La basicità dipende da: – 1) Solvatazione: Aumentando il numero di gruppi alchilici, la solvatazione dello ione diminuisce (e con essa la stabilizzazione dell’acido coniugato), per cui le ammine 2° e 3° hanno basicità simile alle 1°. – 2) Ibridazione dell’azoto: un lone pair in un orbitale a più alta energia è più basico: Nsp3 > Nsp2 > Nsp – 3) Ogni delocalizzazione del lone pair diminuisce la basicità. Basicità NH3 11.0 10.7 10.7 9.3 5.3 4.61 CH3C≡N 1.0 0.0 -1.0 -10.0 29 Acidità • Ammine 1º e 2º sono anche debolmente acide (pKa NH3 = 34). (pKa è qui usato come una misura dell’acidità dell’ammina e non del suo acido coniugato). La reazione ipotetica è: NH3 + H2O → NH2(–) + H3O(+) • Gli stessi fattori che diminuiscono la basicità ne aumentano l’acidità. C6H5SO2NH2 33 27 19 15 10 9.6 • Per la deprotonazione si devono usare basi molto forti, derivati da acidi molto deboli, es. KOH, NaH, RLi o sodio. Per una deprotonazione completa la base deve essere circa 1 milione di volte più forte. 30 Importanti basi organiche Piridina Trietilammina Base di Hünig DBU (C2H5)3N 5.3 10.7 11.4 12 Base di Barton Potassio t-Butossido Sodio HMDS Sodio esametildisilazide LDA Litio diisopropilamide (CH3)3CO(–) K(+) [(CH3)3Si]2N(–) Na(+) 14 19 26 [(CH3)2CH]2N(–) Li(+) 35.7 Reazioni di sali di ammonio quaternario • Il gruppo –NR3+ è un buon gruppo uscente. • La reazione dipende dalla base: – se è un buon nucleofilo, si ha SN2 – se è una base forte di ha E2 SN2 Nu− + R–NR′3 —→ R–Nu + NR′3 Nu−: F−, Cl−, Br−, I−, SNC−, CN−, ArO−, RCOO−, NO3−, ArS− 32 Reazioni di sali di ammonio quaternario • Eliminazione di Hofmann – Se la base è −OH, −OR e vi sono H β, si ha eliminazione. CH3X ecc. NH2 Ag2O / H2O NMe3 X Metilazione esaustiva –AgX NMe3 OH OH H H + 150°C NMe3 95% 5% 33 Reazioni di sali di ammonio quaternario • Eliminazione di Hofmann • Si forma l’alchene meno stabile per astrazione dell’H meno inglombrato (Regola di Hofmann). • Si pensa che lo S.T. abbia carattere carbanionico, non assomigli ai prodotti e quindi non risenta dei fattori che stabilizzano gli alcheni. δOH δOH H H δ- δNMe3 34 Reazioni di sali di ammonio quaternario • Eliminazione di Cope • Quando un N-ossido di un’ammina terziaria viene riscaldato tra 150 e 200°C si ha una reazione di eliminazione con meccanismo sin concertato. Me N Me H2O2 H2O Me N H O Me + Me2N-OH N,N-dimetil idrossilammina base forte Quando si possono avere 2 eliminazioni, si forma l’alchene meno sostituito, salvo quando vi sia in β un fenile: H3C CH2 N O H3C H H3C H H CH3 CH3 calore 93% H2C + H CH3 7% + Me2N-OH 35 Stati di ossidazione dell’azoto • Mentre l’ossigeno ha 2 soli stati di ossidazione, −2 e −1, l’azoto ne ha molti, da −3 a +5. Stato OX Formule (nomi) _3 R3N (ammine) R4N(+) (ammonio) C=N–R (immine) C≡N (nitrili) _2 R2N–NR2 (idrazine) C=N–NR2 (idrazoni) _1 RN=NR (azo composti) R2NOH (idrossil ammina) R3NO (ammina ossido) 0 N2 (azoto) R–N2(+) (diazonio) +1 R–N=O (nitroso) +3 R-NO2 (nitro) RO–N=O (nitrito) 36 Ossidazioni di Ammine • Le ammine sono ossidate facilmente, anche all’aria. • Comuni agenti ossidanti: H2O2 , MCPBA. • Le ammine 2° si ossidano a idrossilammina (−NOH) R2N-H J R2N-OH • Le ammine 3° si ossidano ad ammine ossido (−N+−O-) R3N J R3N-O Reagente Acido Nitroso • L’acido nitroso si produce in situ mescolando sodio nitrito e HCl o H2SO4, in acqua. • L’acido nitroso viene protonato, perde acqua e forma lo ione nitrosonio che è l’agente nitrosante. + H−O−N=O acido nitroso pKa 3.3 H + H−O−N=O H + :N=O + :N≡O + H2O ione nitrosonio elettrofilo • Essendo elettrofilo reagisce con le ammine che sono nucleofili. – Ciò che accade dipende dalla natura dell’ammina, ossia se 1°, 2°, 3°, alifatica o aromatica. Reazioni con Acido Nitroso • Le ammine 1° formano sali di diazonio, R−N+≡N. – I sali di alchildiazonio sono instabili e perdono azoto. – I sali di arildiazonio sono stabili (a bassa t) e sono molto usati in sintesi. • Le ammine 2° formano N-nitrosoammine, R2N−N=O, che sono cancerogene su animali da laboratorio. • Le ammine 3° alifatiche reagiscono a caldo ma si frammentano, quelle aromatiche subiscono nitrosazione al C-para dell’anello, quando libero. Se porta un sostituente reagiscono all’azoto. Reazioni con Acido Nitroso: Diazosali Ammine 1° R−NH2 HNO2 0°C :N=O H R N N=O H X alcoli, cloruri, SN1 H2O alcheni, E1, E2 R = alchile trasposizioni R −H R R−N=N−OH N N=O tautomeria H N-nitrosoammina −N2 R−N≡N X H −H2O R−N=N−OH2 catione diazonio Se R = arile il sale di diazonio è relativamente stabile (-5°C - 0°C) è può essere usato in reazioni successive. 40 Reazioni con Acido Nitroso Ammine 2° R N H R HNO2 0°C :N=O H R N N=O R X −HX R N N=O R N-nitrosoammina Ammine 3° aromatiche N CH3 CH3 O2N N CH3 CH3 NaNO2, HCl, H2O O=N CH3 0°C NaNO2, HCl, H2O 0°C N CH3 O2N CH3 N N=O 41 Sali di Arendiazonio • Stabili in soluzione a 0°–10°C. • I sali di diazonio reagiscono con nucleofili che sostituiscono il gruppo diazonio –+N≡N, liberando azoto. • Dato che l’azoto è una molecola stabile le reazioni sono termodinamicamente favorite. • Le reazioni che usano come catalizzatore sali rameosi si dicono reazioni di Sandmeyer. • La reazione che, con tetrafluoborato BF4–, porta al fluoro derivato si dice reazione di Schiemann. I sali di diazonio e tetrafluoborato sono stabili e possono essere isolati. • La reazione con acido ipofosforoso, H3PO2, rimuove un nitro gruppo o un ammino gruppo e procede probabilmente con meccanismo radicalico. Reazioni dei Sali di Arendiazonio 43 Reazione di diazocopulazione N N N N X Nu− N N Nu azocomposto E>Z • A meno che l’azocomposto non sia stabilizzato, la reazione retroscinde. • La più importante applicazione è la SE aromatica di aromatici attivati da parte del sale di diazonio. Gli azocomposti che si formano sono colorati dal giallo al blu, dipendentemente dalla sostituzione e sono usati come coloranti. Z N N Z X N N + Y Il gruppo Z elettronattrattore aumenta la elettrofilicità dell’N Z N N Il gruppo Y elettrondonatore aumenta la nucleofilicità dell’anello: O-, NR2, NHR, OR Y 44
Scaricare