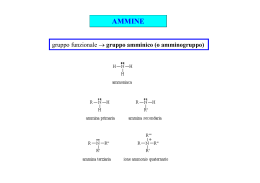
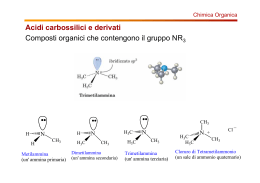
Le Ammine Prof. Paolo Abis Lic. Classico “D. A. Azuni” SASSARI Le ammine • Le ammine possono considerarsi derivati dell’ammoniaca in cui uno o più idrogeni siano stati sostituiti da un gruppo alchilico o aromatico ammoniaca Come nell’ammoniaca, gli orbitali di valenza dell’azoto delle ammine sono ibridati sp3. Tre degli orbitali ibridati sono impegnati in legami con gruppi alchilici o aromatici mentre il quarto è un orbitale atomico. N H3C H CH3 AMMINE: classificazione primarie secondarie N N H R H R1 H R2 terziarie R1 N R3 R2 Le ammine Derivati dell’ammoniaca CH3 - N - H H metilammina CH3 - N - H CH3 dimetilammina C6H5 - N - H H anilina CH3 - N - CH3 CH3 trimetilammina Nelle ammine, come nell’ammoniaca, gli orbitali di valenza dell’azoto sono ibridati sp3. N H H H H N R H Tre degli orbitali sono impegnati in legami con gruppi alchilici o aromatici. Come nell’ammoniaca, il quarto orbitale sp3 è un orbitale atomico contenente un lone pair. R1 N H R2 R1 N R3 R2 Le ammine hanno carattere nucleofilo I gruppi alchilici legati all’azoto, per effetto induttivo positivo, aumentano la densità di carica nell’orbitale atomico. N H3C H CH3 Il lone pair che abita uno dei quattro orbitali conferisce carattere basico alle ammine. N H3C H CH3 Le ammine sono basi deboli e praticamente sono gli unici composti organici con carattere basico Le ammine sono molecole polari H2O H H2 O H N H N CH3 H3 C CH3 H H 2O N H H CH3 CH 3 CH3 Nomenclatura AMMINE PRIMARIE Ci sono due metodi base per dare il nome: il primo viene formato aggiungendo il suffisso ammina al nome del gruppo alchilico legato all’N; il secondo le definisce alcanammine, con l’indicazione della posizione. Nome metilammina o metanammina etilammina o etanammina 2-propilammina o 2-propanammina o isopropilammina ciclobutilammina o ciclobutanammina Caratteristiche Le ammine sono correlate a moltissime sostanze e particolarmente: agli agli alle agli alcaloidi, amminoacidi, proteine acidi nucleici. Alla loro presenza è dovuta la tossicità (e il cattivo odore) della carne e del pesce guasti. Nell'intestino si formano in continuazione ammine (per es., putrescina e triptamina), per azione dei batteri sugli amminoacidi, ma la piccola quantità che entra in circolo nel sangue viene trasformata in composti innocui. Le ammine primarie sono gas o liquidi volatili, dall'odore caratteristico che ricorda quello del pesce non fresco. Utilizzo Ammine a basso peso molecolare: odore sgradevole di pesce putrescina: H2N - CH2CH2CH2CH2 - NH2 Materie prime per la produzione di vernici, coloranti, prodotti farmaceutici Materie plastiche (Nylon) Importanza biologica • Le ammine sono molto diffuse nelle piante e negli animali e molte di esse hanno attività fisiologica Importanza medica • Numerosi farmaci presentano nella loro struttura gruppi amminici: Importanza medica • Numerosi farmaci presentano nella loro struttura gruppi amminici: Proprietà fisiche Le ammine sono composti polari e sia le ammine primarie che quelle secondarie formano legami idrogeno intermolecolari. Il legame a idrogeno N-H--------N è più debole di quello O-H------O perché la differenza di elettronegatività tra l’azoto e l’idrogeno è minore di quella tra l’ossigeno e l’idrogeno Di Conseguenza: I p.e. delle ammine sono inferiori a quelli degli alcoli a ugual peso molecolare Proprietà fisiche Le ammine sono più solubili in acqua degli idrocarburi a ugual peso molecolare La maggior parte delle ammine a basso P.M. è completamente solubile in acqua Le ammine volatili hanno odori caratteristici e spesso sgradevoli. La metilammina ricorda l’ammoniaca; la trimetilammina e la piperidina hanno odori penetranti che ricordano quello di alcuni pesci conservati. Le ammine aromatiche come l’anilina sono tossiche e la loro pericolosità deriva dal fatto che possono essere assorbite attraverso la cute
Scaricare