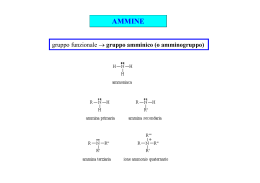
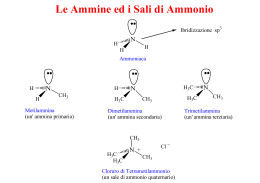
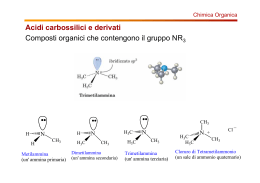
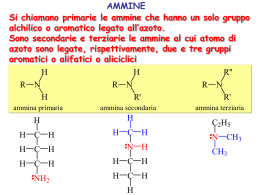
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 14 Ammine e composti eterociclici Organic Chemistry, 5th Edition L. G. Wade, Jr. Prentice Hall Organic Chemistry, 3rd Edition Paula Y. Bruice, Prentice Hall Struttura delle ammine • • Derivati organici dell’ammoniaca L’azoto è ibridizzato sp3 con un doppietto di elettroni su un orbitale sp3. 2 Attività biologica • • • • • Neurotrasmettitori: dopamina Bioregolatori: epinefrina Vitamine: niacina, B6 Alcaloidi: nicotina, morfina, cocaina Amminoacidi 3 Classificazione • • • • Primarie (1): un legame C-N, 2 N-H. Secondarie (2): due C-N, 1 N-H. Terziarie (3): tre C-N, no N-H. Sali di ammonio quaternari (4): quattro C-N, l’azoto ha una carica positiva. CH3 CH3 CH3 C NH2 CH3 N N H _ CH3 Br + CH3CH2 N CH2CH3 CH3 4 Nomi comuni • Si aggiunge il suffisso ammina ai nomi dei gruppi alchilici. (CH3CH2)2NCH3 NHCH3 dietilmetilammina H ciclopentilmetilammina N difenilammina 5 Nomi IUPAC • • La -o dell’acano è sostituita con -ammina. I sostituenti legati all’azoto hanno il prefisso N-. N(CH3)2 Br NH2CH2CH2CHCH2CH3 CH3CH2CHCH2CH2CH3 3-bromo-1-pentanammina N,N-dimetil-3-esanammina Ammine aromatiche • Il gruppo ammino è legato ad un anello benzenico. Il composto base è l’anilina. CH3 NH2 NH2 N CH3 anilina N,N-dimetilanilina H3C 4-metilanilina o p-toluidina Ammina come sostituente • Se c’è un gruppo a priorità maggiore l’ammina è sostituente e si chiama ammino. NH2CH2CH2CH2COOH Acido 4-amminobutanoico OH NHCH3 2-metilamminofenolo 7 Punti di ebollizione • N-H meno polare di O-H. • Il legame idrogeno è più debole. • Le ammine terziarie non possono formare legame idrogeno. Composto Temp. ebollizione CH3CH3 -88.6 °C CH3NH2 -6.3 °C CH3OH 65.0 °C CH3CH2CH2NH2 Le ammine primarie e secondarie sono donatori ed accettori di legame idrogeno 48.7 °C Le ammine terziarie non sono donatori di legame idrogeno (CH3)3N 2.9 °C Solubilità e odore • • • • Le ammine “piccole” (<6 C) sono solubili in acqua. Le ammine sono accettori di legame idrogeno (da acqua ed alcoli ad esempio). La ramificazione aumenta la solubilità. Molte ammine odorano di pesce marcio. NH2CH2CH2CH2CH2CH2NH2 1,5-pentandiammina o cadaverina 9 Basicità delle ammine • • L’azoto ha un doppietto di elettroni e può accettare un protone formando un sale di ammonio Le ammine sono più basiche dell’ammoniaca (ammoniaca: pKb = 4.74) CH3CH2NH2 CH3NH2 H Cl pKb = 3.36 CH3CH2NH3 Cl (CH3)2NH2 pKb = 3.29 10 Effetto della risonanza • La delocalizzazione del doppietto dell’azoto ne diminuisce la basicità. 11 Sali delle ammine • • • Di solito sono solidi con alti punti di fusione Sono solubili in acqua Non hanno odore di pesce 12 Ammine eterocicliche: Piridina • • Composto eterociclico aromatico. Coppia di elettroni di non legame su un orbitale sp2, base debole, pKb = 8.8. 13 Pirrolo • aromatico, la coppia di elettroni di non legame è delocalizzata, fa parte del sistema aromatico, è una base più debole della piridina. 14 Altri eterociclici aromatici 15 Eterocicli aromatici naturali 16 Altri composti eterociclici H O S S N tiacliclopropano ossaciclopropano ossirano ossido di etilene azaciclopropano aziridina O NH2 CH3 tiacliclobutano HN N N O O O N H azaciclopentano pirrolidina O N ossaciclopentano tetraidrofurano (THF) H N H O morfolina N H adenina timina ossaciclobutano N N NH2 N HN N O N O O 1,4-diossano furano S tiofene H2N N N O pirimidina H guanina O tetraidropirano N H citosina N N N N O indolo H benzofurano S benzotiofene N N N chinolina isochinolina purina H Fine del capitolo 14 18
Scaricare