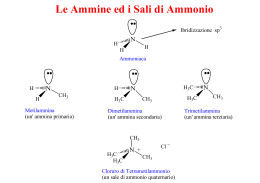
AMMINE Si chiamano primarie le ammine che hanno un solo gruppo alchilico o aromatico legato all’azoto. Sono secondarie e terziarie le ammine al cui atomo di azoto sono legate, rispettivamente, due e tre gruppi aromatici o alifatici o aliciclici H H R'' R N R N R N H R' R' ammina primaria ammina secondaria H H H C H H C H H C H N H H C H H C H NH2 H C H H ammina terziaria C2H5 N CH3 CH3 Ammine alifatiche H H H H C H H C H H C H H C H H C H NH2 metanammina amminometano metilammina H NH2 etanammina amminoetano etilammina H C H H H C H NH2 1-propanammina 1-amminopropano 1-propilammina H 2-propanammina 2-amminopropano 2-propilammina H H C H C2H5 H C H N CH3 N-metil-etanammina N-metil-amminoetano metil etil ammina H C NH2 H C H N H H H C H CH3 N,N-dimetil-etanammina N,N-dimetil-amminoetano dimetil etil ammina H H H H H H H CH3 N H H H H N-metil-cicloesanammina N-metil-amminocicloesano dimetil cicloesil ammina NH2 Ammine aromatiche CH3 benzenammina amminobenzene fenilammina anilina N H CH3 H3C C CH3 N CH3 N-metilbenzenammina N-metil-amminobenzene metilfenilammina N-metil-anilina N-metil-N-2(2-metilpropil)benzenammina N-metil-N-tert-butil-amminobenzene metil-tert-butil-fenilammina N-metil-N-isopropil-anilina CH3 NH2 CH3 CH2 H2N C H CH2 CH2 NH CH2 CH2 CHOH CHOH HO HO 2-feniletanammina 1-fenil-2-propanammina (anfetammina) NH2 NH2 H C H H C H OH NH2 2-amminoetanolo (etanolammina) H C H H C H H C H H C H NH2 OH OH nor-adrenalina adrenalina H NH2 N H C H H C H H H H C H H H H H H C H H C H NH2 1,4-butandiammina 1,5-pentandiammina (putrescina) (cadaverina) H H pirrolidina Come nell’ammoniaca, gli orbitali di valenza dell’azoto delle ammine sono ibridati sp3. Tre degli orbitali ibridati sono impegnati in legami con gruppi alchilici o aromatici mentre il quarto è un orbitale atomico. N H3C H CH3 Nelle ammine gli orbitali dell’azoto sono ibridati sp3. Il lone pair che abita uno dei quattro orbitali conferisce carattere basico alle ammine. I gruppi alchilici legati all’azoto, per effetto induttivo positivo, aumentano la densità di carica nell’orbitale atomico. N H3C H CH3 Per il loro carattere basico, le ammine reagiscono con gli acidi minerali come basi di Brönsted, trasformandosi in sali di alchilammonio. H HCl N Cl - N H CH3 cloruro di metilammonio H H CH3 amminometano H H N H3C HOOCCH3 CH3 CH3 N,N-dimetilamminometano N H3C -OOCCH 3 CH3 CH3 acetato di trimetilammonio NH2 H N H C2H5 C2H5 C2H5 H5C2 N H5C2 N H C2H5 Carattere nucleofilo dell’azoto amminico La nucleofilia dell’azoto del gruppo funzionale delle ammine è influenzata dalla natura dei gruppi alchilici o aromatici legati all’azoto. Nelle ammine alifatiche, aumentando il numero dei gruppi alchilici aumenta la densità elettronica nell’orbitale atomico dell’azoto e quindi il carattere nucleofilo. La presenza di un radicale aromatico, a causa della delocalizzazione dei due elettroni dell’azoto nell’orbitale p dell’anello, rende le ammine meno nucleofile. Nonostante che il carattere nucleofilo delle ammine terziarie alifatiche sia maggiore di quello delle ammine alifatiche secondarie e primarie, le ammine terziarie hanno valori di Kb più bassi (sono meno basiche), a causa dell’ingombro dei tre gruppi alchilici. La spontaneità del processo di protonazione dell’ammina da parte dell’acqua è infatti tanto maggiore quanto maggiore è la stabilità della forma protonata. La stabilità di questa forma è maggiore per le ammine che, avendo minore ingombro sterico, possono essere maggiormente solvatate. Kb = 6 • 10-4 N CH3 H CH 3 Kb = 5 • 10-4 Kb = 6.6 • 10-5 N N H H+ H H CH3 H 3C CH3 H+ H+ H H H N N N CH3 CH3 H H CH3 H3 C CH3 CH 3 CH3 Le ammine aromatiche hanno carattere nucleofilo (e anche carattere basico) minore di quello delle ammine alifatiche e alicicliche. La presenza del radicale aromatico comporta infatti la delocalizzazione dei due elettroni dell’azoto nell’orbitale p dell’anello. L’effetto mesomerico comporta che il valore di Kb dell’amminobenzene è circa un milione di volte più piccolo di quello dell’amminocicloesano. Kb = 4,2 • 10-10 N H H benzenammina Kb = 5,5 • 10-4 N H H cicloesanammina Le caratteristiche nucleofile delle ammine le dispone a reazioni di sostituzione (SN) I H H C H H C N H H H H CH3 N H CH3 I- H CH3 N H CH3 HI L’ammina primaria fa un attacco nucleofilo sul carbonio legato all’atomo di alogeno. Si forma un’ammina secondaria. Se è presente un eccesso di alogenoderivato alchilico, il forte carattere nucleofilo dell’ammina secondaria comporta la possibilità di un secondo attacco nucleofilo ... I H H C H C N H H H CH3 CH3 N H H CH3 I- CH3 CH3 N CH3 CH3 HI Dall’attacco nucleofilo dell’ammina secondaria sulla seconda molecola di alogeno-derivato alchilico si ha la formazione di un’ammina terziaria. Se è presente un eccesso di alogenoderivato alchilico, il forte carattere nucleofilo dell’ammina terziaria comporta la possibilità di un terzo attacco nucleofilo ... I H H C H C N H3C H H CH3 CH3 N H3C H ICH3 CH3 Il terzo attacco nucleofilo porta alla formazione del sale di tetraalchilammonio (nella reazione portata ad esempio si forma ioduro di tetrametilammonio). OH OH OH OH H C H H C H H C H H C H H C H H C H H C H H C H H N H N H3C N H CH3 CH3 H3C N CH3 CH3 X La “metilazione esauriente” del 2-amminoetanolo (etanolammina) porta alla formazione del sale di tetrametilammonio corrispondente (colina) La reazione delle ammine con acido nitroso porta a formazione di importanti derivati HO N O + H H O N H O N O N O catione nitrosile Nella prima tappa della reazione (protonazione dell’acido nitroso) si forma l’elettrofilo (il catione nitrosile) Nella seconda tappa, il nucleofilo catione nitrosile attacca l’ammina. Per eliminazione di una molecola di acqua si forma uno ione diazonio instabile che, in ambiente acquoso, elimina azoto molecolare e si converte nel corrispondente alcole. Ammina primaria H H R N O N O R N N H H H O R N N H O H H R N N ione diazonio H2 O H+ R OH N2 HO N O H+ H O N O N O O N NITROSAMMINE !!! H catione nitrosile Nella prima tappa della reazione (protonazione dell’acido nitroso) si forma l’elettrofilo (il catione nitrosile) Ammina secondaria R' R N H N O R' R N N O H H+ R' R N N O nitrosammina Nella seconda tappa, il nucleofilo catione nitrosile attacca l’ammina. Per eliminazione del protone catalitico, si ha la formazione di una nitrosammina. Le ammine terziarie reagiscono con i nitriti in ambiente acido per dare sali di trialchilnitrosoammonio Ammina terziaria R' R N R'' N O R' R N N O R'' ione trialchilnitrosammonio Le ammine aromatiche primarie reagiscono con i nitriti in ambiente acido per dare sali di diazonio, stabili a bassa temperatura. NH2 N N N N NaNO2 (H+) in acqua a 0°C catione diazonio Cl N2 N In presenza di sali rameici i sali di diazonio si possono convertire in altri derivati aromatici. CN N N2 OH H2O H+ + N2 A caldo e in presenza di acqua, i sali di diazonio si convertono nei corrispondenti fenoli, eliminando una molecola di azoto. O R H N R' C H H H2O O H R C N H H R' N R' R C H aldimmina (base di Schiff) Le ammine primarie agiscono da nucleofili nei confronti dei composti carbonilici. L’allontanamento di una molecola di acqua dall’intermedio della reazione porta alla formazione di una base di Schiff (è il vecchio nome dato alle aldimmine e alle chetimmine) Le ammine secondarie e terziarie non possono dare questa reazione. O H+ H R C N R' R C X H O O X- N H H R' R C N H R' Le ammine agiscono da nucleofili nei confronti dei derivati degli acidi carbossilici (esteri, alogenuri acilici, anidridi). La reazione è una sostituzione nucleofila di 2° ordine. Se si è partiti da un alogenuro acilico e da un’ammina primaria, per allontanamento dello ione alogenuro dall’intermedio si forma un’ammide protonata che, per successivo allontanamento di in protone, dà luogo alla formazione di un’ammide monoalchilsostituita.
Scaricare