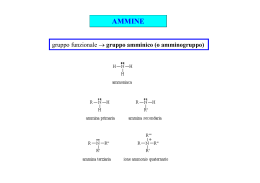
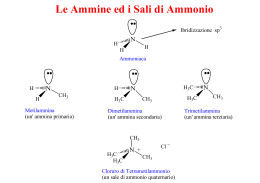
Chimica Organica Acidi carbossilici e derivati Composti organici che contengono il gruppo NR3 CH3 H N H H CH3 Metilammina (un' ammina primaria) H3C H3C N CH3 Dimetilammina (un' ammina secondaria) H3C N CH3 Trimetilammina (un' ammina terziaria) H3C H3C Cl N + _ CH3 Cloruro di Tetrametilammonio (un sale di ammonio quaternario) Chimica Organica Nomenclatura delle ammine Le ammine primarie prendono il nome aggiungendo la desinenza –ammina aI nome dei sostituenti organici. Se nella struttura compaiono altri gruppi funzionali, il gruppo amminico si considera un sostituente, a cui si dà il nome di ammino, legato alla molecola di riferimento: Chimica Organica Nomenclatura delle ammine Le ammine secondarie e terziarie simmetriche si denominano utilizzando i prefissi di- o tri- nei nomi dei gruppi alchilici. Le ammine secondarie e terziarie sostituite asimmetricamente vengono considerate ammine primarie N-sostituite. Come ammina primaria di riferimento si sceglie quella col gruppo più grande. Chimica Organica Nomi comuni di alcune ammine aromatiche N N N N H Purina Chimica Organica DNA: basi puriniche e pirimidiniche Chimica Organica DNA: basi puriniche e pirimidiniche Chimica Organica Alcaloidi naturali H N N CH3 Chimica Organica Proprietà delle ammine RNH2 + [RNH Keq.= RNH3+ + H2O + 3 ] - [OH ] [RNH2] [H2O] pK b = -log K b Kb= OH- [RNH 3+] [OH-] [RNH2] pK b + pK a = 14 Chimica Organica Proprietà delle ammine Ammina Struttura pKb pKa (acido coniugato) Dietilammina (CH3CH2)2NH 3.06 10.94 Trietilammina (CH3CH2)3N 3.21 10.79 Etilammina (CH3CH2)NH2 3.25 10.75 Dimetilammina (CH3)2NH 3.27 10.73 Trimetilammina (CH3)3N 3.36 10.64 Metilammina CH3NH2 4.21 9.79 Ammoniaca NH3 4.74 9.26 Anilina PhNH2 9.37 4.63 p-NO2-Anilina p-NO2-PhNH2 13.0 Base più Forte Base meno Forte 1.0 Nonostante la somiglianza strutturale, le ammidi non sono basi. La spiegazione è data dalle formule di risonanza. Chimica Organica Ammine aromatiche: piridina 1 6 N 5 2 N N 3 4 pKb = 8.7 N N Chimica Organica Ammine aromatiche: anilina H H C H C C C N H H C H H Anilina pKb = 9. 4 Chimica Organica Ammine aromatiche: pirrolo X X X … pKb = 14 Chimica Organica Proprietà delle ammine: legami a idrogeno Composto CH3CH3 CH3OH CH3NH2 CH3CH2CH3 CH3CH2OH CH3CH2NH2 Peso Molecolare 30 32 31 44 46 45 Punto di ebollizione, °C -88.6° 65° -6.0° -42° 78.5° 16.6° Chimica Organica Preparazione delle ammine Riduzione di nitrili CN R CN R Cl LiAlH4 R CH 2NH 2 Riduzione di ammidi R COCl R'NH 2 R CONHR' LiAlH4 R CH 2NHR' Riduzione di nitrobenzeni NO2 SnCl 2 Ammionazione riduttiva O CH3 NH2 H NH3 CH3 CH3 N NH2 NaBH 4 CH3 Alchilazione di alogenuri (lucidi successivi) CH3 CH3 Chimica Organica Reazioni delle ammine Formazione di sali Chimica Organica Reazioni delle ammine Formazione di sali distreomerici Chimica Organica Reazioni delle ammine Sostituzione nucleofila: alchilazione N R3 H R2 N R X R3 R + HX R2 Riguarda tutte le ammine, dall'ammoniaca alle ammine terziarie E’ sempre possibile la polialchilazione: la ammine sostituite sono più reattive di quelle meno sostituite Chimica Organica Reazioni delle ammine Sostituzione nucleofila: acilazione RCOX N R3 H R2 N R3 O C R + HX R2 un' ammide Riguarda l'ammoniaca e le ammine primarie e secondarie ma non le terziarie
Scaricare