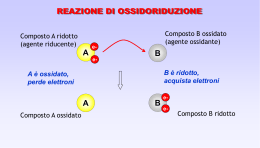
Celle galvaniche (pile) • Una cella galvanica sfrutta una reazione chimica spontanea per generare corrente elettrica • Occorre: – una reazione redox spontanea – non contatto fra ossidante e riducente – un circuito esterno per gli elettroni – un ponte per gli ioni Pila Daniell • Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) • Cu2+(aq) + 2 e- → Cu(s) • Zn(s) → Zn2+(aq) + 2 e- Potenziale di cella • se il circuito esterno è aperto, non passa corrente, e si misura una differenza di potenziale E (in volt V) • conviene pensare E come differenza fra i potenziali dei due elettrodi E = E1 - E2 • il potenziale di riduzione E di un elettrodo misura il potere ox dell'ossidante e (all'opposto) il potere red del riducente Potenziali standard • il potenziale E di un elettrodo dipende dalle concentrazioni • il potenziale standard E0 si ha quando reagenti e prodotti sono allo stato di riferimento (a = 1, solidi o liquidi o c =1M o P = 1 atm) • 2 Ag+(aq) + Fe(s) → 2 Ag(s) + Fe2+(aq) • E0 = E0(Ag+/Ag) - E0(Fe2+/Fe) n = numero di elettroni trasferiti G° = - n F E° F = 9,65 x 104 J/(Vmol) , costante di Faraday ( 1 F = 1 mol di elettroni ) Se G° 0 , E° 0 : è favorita la formazione dei prodotti E = E° - (RT/nF) ln Q ( equazione di Nernst ) R = costante dei gas, Q = quoziente di reazione 0,059 E = E° log Q n a 25°C Zn(s) MnO2 + NH4+ + e- 4 NH3 + Zn 2+ Zn2+ + 2 eMnO(OH) + NH3 Zn(NH3)42+ Pb(s) + SO42PbO2(s) + SO42- + 4 H+ + 2 e - PbSO4(s) + 2 ePbSO4 (s) + 2 H2O
Scaricare