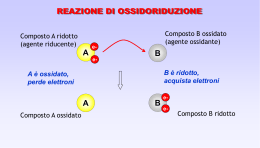
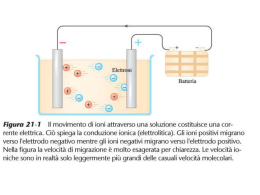
REAZIONI DI OSSIDAZIONE-RIDUZIONE • Nelle reazioni di ossidazione-riduzione (redox) avviene il trasferimento di e- da un atomo ad un altro. Si possono scomporre in due semireazioni: - riduzione, che consiste nell’acquisto di e-, - ossidazione, che consiste nella perdita di e-, ox1 + e- red1 red2 ox2 + eox1 + red2 red1 + ox2 • red1/ox1 e red2/ox2 sono le due coppie redox: ox1è l’agente ossidante, che accettando e- provoca l’ossidazione di red2; red2 è l’agente riducente, che donando e- riduce ox1. • Gli e- sono perfettamente bilanciati tra le semireazioni di riduzione e ossidazione. Per determinare i coefficienti stechiometrici si applica la semplice regola del “minimo comune multiplo: Al + Br2 Al3+ + Brnon bilanciata Al - 3e- Al3+ Br2 + 2e- 2Br2Al + 3Br2 2Al3+ + 6Br- bilanciata • L’ossidazione porta ad un aumento dello “stato o numero di ossidazione” e la riduzione determina una diminuzione del numero di ossidazione. • Il numero di ossidazione indica la carica che un atomo possiede come ione o la carica che avrebbe, all’interno di una molecola, se gli e- di legame venissero attribuiti interamente all’atomo più elettronegativo: - in una molecola la somma algebrica dei numeri di ossidazione deve essere 0, - O ha quasi sempre –2, - H ha quasi sempre +1, - F ha sempre –1, - C può presentare tutti i numeri di ossidazione da –4 a +4, - Mn può presentare tutti i numeri di ossidazione da +2 a +7, - nelle molecole biatomiche o nei metalli allo stato elementare, i singoli atomi hanno numero di ossidazione 0. Mn2+ Mn4+ Mn6+ Mn7+ MnCl2 MnO2 MnO42- MnO4- • Un modo semplice per riconoscere una equazione redox è annotare le variazioni dei numeri di ossidazione di due elementi diversi: 2Na + Cl2 2NaCl • Il trasferimento di e- avviene da atomi elettropositivi, che si ossidano, ad atomi più elettronegativi, che si riducono: Zn(s) + 2H+(aq) Zn2+(aq) + H2(g) DEl=0.5 Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s) DEl=0.2 Reazione spontanea Zn/H+ H+ in soluzione si riduce a H2 gas e gli atomi di Zn0 si ossidano a Zn2+. Reazione spontanea Zn/Cu2+ Cu2+ in soluzione (blu) si riduce a Cu0 depositandosi sulla lamina di Zn0, che si ossida a Zn2+. Celle voltaiche • Almeno in teoria, qualsiasi reazione redox spontanea può servire come fonte di energia elettrica in una cella voltaica, in cui il trasferimento di e- avviene indirettamente. Cella voltaica Zn/Cu2+ Nella semicella di sinistra un elettrodo di Cu0 è immerso nella soluzione di Cu2+, in quella di destra un elettrodo di Zn0 è immerso nella soluzione di Zn2+. I due elettrodi sono collegati da un circuito esterno con due conduttori e un voltmetro. Spontaneamente all’elettrodo di Zn (anodo-polo negativo) avviene l’ossidazione di Zn0 a Zn2+ e l’anodo “pompa” e- nel circuito. Gli e- si muovono fino all’elettrodo di Cu (catodo-polo positivo) dove vengono“consumati” per la riduzione di Cu2+ a Cu0. Il ponte salino contiene KNO3 e riversa NO3- e K+ alla semicella anodica e catodica rispettivamente per mantenere l’elettroneutralità. Celle voltaiche Zn(s) + 2H+(aq) Zn2+ + H2(g) Cella voltaica Zn/H+ Nella semireazione catodica si usa un elettrodo inerte (Pt) circondato da una soluzione di H+ e su cui viene fatto gorgogliare H2(g). Cl2(g) + 2Br- 2Cl- + Br2 Cella voltaica Br-/Cl2 Entrambi gli elettrodi sono di Pt Potenziali standard • La forza che guida la reazione spontanea in una cella voltaica è misurata dal potenziale della cella, che dipende dalla natura della reazione di ossidoriduzione (differenza di elettronegatività) e dalla concentrazione delle specie coinvolte. • Il potenziale standard è quello misurato quando tutti gli ioni e le molecole nelle soluzioni hanno concentrazione 1M e tutti i gas sono alla pressione di 1 atm. Zn(s) + 2H+ (aq,1M) Zn2+(aq, 1M) + H2(g, 1atm) E°=+0.762V +0.762=E°oss(ZnZn2+) + E°rid(H+H2) Esistono le convenzioni che: E°rid(H+H2)=0.000V E°oss(ZnZn2+)=+0.762V E°rid(Zn2+Zn)=-0.762V • I potenziali standard delle semi-reazioni di riduzione per le diverse coppie redox sono tabulati. Essi forniscono il criterio per stabilire se una coppia redox ha tendenza a ridursi piuttosto che ad ossidarsi rispetto ad una seconda coppia redox: gli efluiranno spontaneamente dalle coppie a E°rid più negativo (agente riducente) a quelle a E°rid più positivo (agente ossidante). • E’ stato dimostrato che: DG=-nFDE°=-nF(E°rid-E°oss) dove n=numero di e- trasferiti e F=costante di Faraday (9.648.104J/mole) • Si deduce che: DG°=-RTlnKeq=-nFDE° RTlnKeq=nFDE° DE°=(RT/nF).lnKeq Se DE°>0, lnKeq è positivo e Keq>1, viceversa se DE°<0, lnKeq è negativo e Keq<1 (es: se DE°=0.1V, Keq=2.103; se DE°=-0.1V, Keq=4.10-4) • Quando una cella voltaica è in funzione, fornendo energia elettrica, la concentrazione dei reagenti diminuisce e quella dei prodotti aumenta. Il potenziale scende costantemente fino a diventare 0 (la cella è “morta”). A quel punto la reazione è all’equilibrio e non c’è più produzione di voltaggio. • L’equazione di Nerst ha stabilito la relazione tra potenziale di cella DE (f.e.m.) e concentrazione dei reagenti e dei prodotti. Da DG=DG° + RTlnQ -nFDE= -nFDE° + RTlnQ DE=DE° -(RT/nF).lnQ a 25°C DE=DE° -(0.0257/n).lnQ Se Q>1, cioè le concentrazioni dei prodotti sono più alte di quelle dei reagenti, lnQ è positivo e DE< E°; se Q<1, cioè la concentrazione dei prodotti sono minori di quelle dei reagenti, DE> DE°; se Q=1, come nelle condizioni standard, lnQ=0 e DE=DE°. Nell’espressione di Q i gas entrano con le loro pressioni parziali in atm, le specie in soluzioni con le concentrazioni molari e i solidi non compaiono. • In laboratorio, l’uso più importante che si fa dell’equazione di Nerst è nella determinazione sperimentale della concentrazione di ioni in soluzione (pH-metro). Elettrodo di vetro per pH L’elettrodo consiste in due semicelle: una semicella è di riferimento a potenziale noto, l’altra semicella contiene una soluzione a pH noto separata da una fragile e sottile parete di vetro dalla soluzione il cui pH deve essere determinato. Il potenziale di questa cella è funzione del pH incognito. Pile voltaiche commerciali Pile primarie non ricaricabili Pila a secco Zn-MnO2 La reazione originariamente era: Zn(s)+2MnO2(s)+2NH4+(aq) Zn2+(aq)+Mn2O3(s)+2NH3(aq)+H2O Nelle pile alcaline NH4+ è sostituito da KOH: Zn(s)+ 2MnO2(s) Zn2+(aq)+Mn2O3(s) Pile accumulatrici ricaricabili Accumulatore al piombo Quando fornisce corrente: anodo Pb(s)+SO42-(aq)PbSO4(s)+2ecatodo PbO2(s)+4H+(aq)+SO42-(aq)+2ePbSO4(s)+2H2O Durante la ricarica: 2PbSO4(s)+2H2OPb(s)+PbO2(s)+4H+(aq)+2SO42-(aq) Celle elettrolitiche Nelle celle elettrolitiche viene realizzata una reazione di ossidoriduzione non spontanea immettendo energia elettrica nel sistema. L’elettrolisi di una soluzione acquosa di NaCl produce: 2Cl-(aq)Cl2(g)+2e2H2O+2e-H2(g)+2OH-(aq) Gli e- entrano nel catodo (polo negativo) da una sorgente esterna. I cationi si muovono verso il catodo dove vengono ridotti e gli anioni verso l’anodo (polo positivo) dove vengono ossidati. Elettrolisi di soluzioni acquose soluzione catodo anodo CuBr2(aq) Cu(s) Br2(l) AgNO3(aq) Ag(s) O2(g) KI(aq) H2(g) I2(s) Na2SO4(aq) H2(g) O2(g) NaCl(aq) H2(g) Cl2(g)
Scaricare