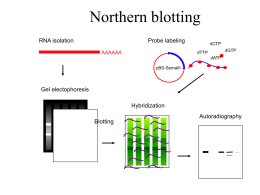
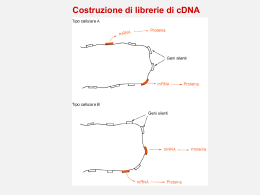
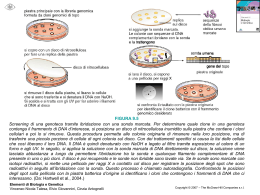
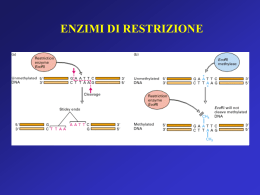
COSTRUZIONE DI GENOTECHE Definizione di genoteca Una genoteca è una collezione completa di frammenti di DNA, inseriti singolarmente in un vettore di clonaggio. ¾ Genoteche di DNA genomico ¾ Genoteche di DNA cromosomico ¾ Genoteche di cDNA GENOTECHE DI DNA GENOMICO Perché costruire una genoteca genomica? Per mappare il genoma. Per identificare/isolare un gene. Tappe per la costruzione di una genoteca genomica 1. Isolamento del DNA da un organismo 2. Taglio del DNA in frammenti 3. Legame dei frammenti di DNA con un vettore di clonaggio opportunamente scelto 4. Trasferimento del vettore ricombinante nell’organismo ospite 5. Selezione del clone contenente il gene di interesse 6. Recupero del vettore ricombinante e del frammento di DNA di interesse Caratteristiche di una genoteca genomica Una genoteca per essere utile deve essere completa e rappresentativa: rappresentativa deve contenere tutto il genoma di un organismo e ogni parte del genoma deve essere ugualmente rappresentata Per ottenere una genoteca con tali caratteristiche è necessario tagliare il genoma in FRAMMENTI GRANDI (per clonarli in vettori di clonaggio ad alta capacità) CASUALI (generati da tagli casuali) OMOGENEI (aventi tutti la stessa lunghezza) PARZIALMENTE SOVRAPPONIBILI (caratteristica essenziale per il mappaggio ed il sequenziamento di geni molto grandi) Taglio del DNA genomico in frammenti grandi e casuali • Rottura meccanica (Si generano frammenti con estremità piatte) Sonicatore Siringa ad ago molto sottile • Digestione enzimatica parziale (Si generano frammenti con estremità piatte o sporgenti a seconda dell’enzima utilizzato) Produzione dei frammenti da clonare per digestione enzimatica parziale Per ottenere una digestione parziale bisogna limitare la quantità e/o il tempo di incubazione dell’enzima con il DNA genomico. Prima del clonaggio bisogna selezionare i frammenti in base alla loro lunghezza. ……ma quanti cloni sono necessari per ottenere una genoteca completa????? • dimensione del genoma (esempio: genoma umano 2,8 x 106 kb) • dimensione media dei frammenti da clonare (esempio 20 kb) Calcolare: n: grandezza del genoma / dimensione media dei frammenti da clonare n: 2,8 x 106 kb / 20 kb = 1,4 x 105 frammenti Considerando la variabilità e la casualità del clonaggio, abbiamo bisogno di ottenere un numero di cloni ricombinanti ben maggiore di n per ottenere una genoteca completa. E’ possibile calcolare esattamente il numero di cloni ricombinanti in relazione alla probabilità di includere una data sequenza nella genoteca: ln(1-P) N= ln(1-0,95) = 4,2 x N= ln(1-1/n) ln(1-0,99) ln(1-1/ 1,4 x 105) 105 = 6,5 x 105 N= ln(1-1/ 1,4 x 105) N= numero di cloni necessari per avere una genoteca completa P= probabilità che una regione genomica qualsiasi sia inclusa nella genoteca; ln= logaritmo naturale del numero in parentesi Dimensioni ottimali di genoteche genomiche in funzione dei vettori utilizzati Organismo Dimensione Tipo di del genoma vettore Dimensione P Dell’inserto Dimensione della libreria Batterio 4 × 106 Plasmide Fago λ Cosmide BAC 4 kb 18 kb 40 kb 300 kb 0.99 0.99 0.99 0.99 4.6 × 103 1.0 × 103 458 59 Mammifero 3 × 109 Plasmide Fago λ Cosmide BAC 4 kb 18 kb 40 kb 300 kb 0.99 0.99 0.99 0.99 3.5 × 106 7.7 × 105 3.5 × 105 4.6 × 104 Costruzione di una genoteca genomica rappresentativa in vettori λ Charon 4A Maniatis et al., 1978 Costruzione di una genoteca genomica rappresentativa in vettori λ EMBL GENOTECHE DI DNA CROMOSOMICO GENOTECHE DI DNA CROMOSOMICO Mediante l’uso di un apparecchio chiamato FACS, FACS Fluorescence Activated Cell Sorter, si possono isolare singoli cromosomi umani sulla base delle loro dimensioni. Una volta separato qualche milione di cromosomi di un solo tipo, se ne può estrarre il DNA e farne una genoteca come se si trattasse di un normale genoma. Esistono 24 genoteche cromosomiche umane: una per ciascuno dei 22 autosomi, una per l’X e una per Y. Il vantaggio delle genoteche cromosomiche è che richiedono un numero di cloni dalle 10 alle 30 volte inferiore a quello richiesto per una genoteca genomica e permettono una maggiore rapidità nell’individuazione e nella purificazione di cloni specifici. GENOTECHE DI cDNA Caratteristiche delle genoteche di cDNA Definizione I cloni di una genoteca di cDNA rappresentano gli mRNA maturi presenti in un tipo cellulare al momento in cui è stato estratto l’RNA. Una genoteca di cDNA riflette, quindi, l’attività genica di una data popolazione cellulare in un determinato momento dello sviluppo dell’organismo. Pertanto una genoteca di cDNA è tessuto e stadio specifica. Perchè costruire una genoteca di cDNA? Per isolare geni molto grandi (es: il gene della distrofina umana è lungo 2,5 Mb) Per esprimere la proteina in batteri Per studiare la struttura di un gene confrontando il cDNA con il gene Per studiare l’espressione tessuto- e stadio-specifica di un gene Tappe della costruzione di una genoteca di cDNA • Isolare l’RNA totale di una popolazione cellulare • Purificare gli mRNA • Sintetizzare i cDNA • Clonare i cDNA in vettori di clonaggio Isolamento dell’mRNA dall’RNA totale In seguito all’estrazione di RNA totale da una popolazione cellulare si ottiene: 10% di mRNA; 15% di tRNA; 75% di rRNA Caricamento TTTTT TTTTT AAAAAAAA AAAAAAAA La purificazione del mRNA su colonne di oligo (dT) sfrutta l’affinità tra le code di poli(A) degli mRNA e le dT immobilizzate su un supporto solido Lavaggio TTTTT Eluizione TTTTT TTTTT TTTTT TTTTT AAAAA TTTTT TTTTT TTTTT TTTTT AAAAA TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT TTTTT AAAAAAAA AAAAAAAA AAAAAAAA cDNA Library Construction mRNA 5’ Reverse transcription 5’ mRNA Rev. cDNA Trans. hybrid 3’ 5’ AAAAAAAAAAA3’ TTTTTTTTTTTT5’ AAAAAAAAAAA3’ TTTTTTTTTTTT5’ AAAAAAAAAAA3’ cDNA after RNaseH treatment 3’ RN aseH TTTTTTTTTTTT5’ Double stranded cDNA after DNA polymerase 3’ 5’ Insert into vector A A A AA A A DNA Pol TTTTTTTTTTTT5’ AAAAAAAAAAA3’ Costruzione di una genoteca di cDNA (A) Sintesi di cDNA a doppio filamento con oliogo dT, trascrittasi inversa, RNasi H, DNA polimerasi e nucleasi S1 Clonaggio delle molecole di cDNA a doppio filamento con estremità piatte aggiungendo code omopolimeriche di dCTP con la terminal trasferasi Svantaggio. Perdita dell’informazione al 5’ per l’attività della nucleasi S1 Costruzione di una genoteca di cDNA (B) Aggiunta di code omopolimeriche all’estremità 3’ del 1° filamento di cDNA neosintetizzato ad opera della terminal transferasi Il gradiente di saccarosio alcalino serve: 1) per l’idrolisi dell’RNA 2) per recuperare i cDNA e allontanare i ribonucleotidi ottenuti dall’idrolisi dell’RNA Il clonaggio avviene mediante l’aggiunta di ulteriori code omopolimeriche tramite linker Clonaggio direzionale dei cDNA DNA polimerasi + dNTP Vantaggio: permette di clonare l’inserto nell’orientamento giusto a fini dell’espressione Limiti delle strategie convenzionali basate sull’utilizzo degli oligo dT 9Gli RNA procaritici e alcuni mRNA eucariotici non hanno code di poliA 9L’innesco all’estremità 3’ dei trascritti induce la creazione di genoteche arricchite di molecole di cDNA che rappresentano le estremità 3’ dei messaggeri 9Per trascritti lunghi è difficile ottenere cDNA interi (full-lenght) E’ necessario clonare cDNA completi se si vuole esprimere la proteina o quando si vuole studiare la struttura del gene La sintesi del cDNA produce, a partire da molecole di messaggero uguali, molecole di DNA di diversa lunghezza. Sovrarappresentazione del 3’ se la sintesi è innescata da oligo-dT cDNA-1 (full-lenght) 3’ 5’ mRNA cDNA-2 3’ 5’ cDNA-3 3’ 5’ 3’ 5’ TTTTTTTT 5’ AAAAAAAA 3’ cDNA-4 TTTTTTTT 5’ AAAAAAAA 3’ TTTTTTTT 5’ AAAAAAAA 3’ TTTTTTTT 5’ AAAAAAAA 3’ Produzione di cDNA completi Selezione dei cDNA completi con l’ RNasi A che degrada esclusivamente gli RNA a singolo filamento, lasciando intatti gli ibridi DNA-RNA Isolamento delle molecole a lunghezza completa grazie alla loro affinità per il fattore di inizio della traduzione eIF4E, che lega il cap presente all’estremità 5’ degli mRNA La PCR come alternativa al clonaggio dei cDNA La trascrizione inversa seguita da PCR (RT-PCR) porta all’amplificazione di mRNA sottoforma di cDNA. Se si utilizzano primer specifici per un cDNA si ottiene l’amplificazione selettiva di quel cDNA. E’ una tecnica rapida e sensibile che permette di: • determinare la presenza o l’assenza di un trascritto in un tipo cellulare • stimare i livelli di espressione di un trascritto (trascrizione inversa + real time) • clonare un cDNA senza la necessità di costruire ed analizzare una genoteca di cDNA Si ricorre alla costruzione della genoteca di cDNA se: • non si conosce la sequenza del cDNA e pertanto non si possono costruire i primer specifici • difficile reperibilità del materiale biologico Costruzione di una genoteca di cDNA mediante RT-PCR Se si utilizzano primer universali si amplificano tutti i cDNA presenti nel campione di partenza. Dopo amplificazione per PCR i cDNA possono essere clonati per ottenere una genoteca di cDNA. Vantaggio: Vantaggio se il materiale biologico di partenza è molto scarso. Svantaggio: Svantaggio i cDNA più corti si amplificano meglio di quelli più lunghi pertanto risulteranno sovrarappresentati nella genoteca. SCREENING DI GENOTECHE A Library The clone of interest Sreening delle genoteche Sulla base della sequenza nucleotidica Ibridazione • cDNA • gene di specie diversa • sonda dedotta da seq. parziale proteina • chromos. walking Applicabile a tutte le genoteche Sulla base della struttura/funzione (vettori di espressione) • riconoscimento con Ab • interazione con ligandi • complementazione/acquisizione di funzione Applicabile alle genoteche di cDNA costruite con vettori di espressione Screening mediante ibridazione con acidi nucleici: colony blot Autoradiogarfia Le colonie batteriche da analizzare vengono trasferite su di una membrana di nitrocellulosa o di nylon mediante la tecnica del replica plating Screening mediante ibridazione con acidi nucleici: plaque lift Le placche fagiche da analizzare vengono trasferite su di una membrana di nitrocellulosa o di nylon mediante la tecnica del replica plating Lo screening di placche fagiche presenta due vantaggi: 1. da una singola piastra madre si possono produrre più repliche pertanto si possono effettuare screening multipli; 2. il segnale di ibridazione è più pulito poiché si trasferisce sul filtro meno DNA cromosomico batterico, che può ibridare in maniera aspecifica con la sonda Screening mediante ibridazione con acidi nucleici: arrayed libraries I singoli cloni vengono prelevati e trasferiti in maniera ordinata su una membrana, a formare una griglia. I singoli cloni vengono prelevati dalla piastra e inoculati in pozzetti di piastre microtiter. Macchine robot prelevano contemporaneamente tutti i cloni da una piastra microtiter e li depositano sulla membrana. Questo processo automatizzato consente di ottenere copie multiple delle membrane da ibridare. Sonde di ibridazione per lo screening di genoteche 9Sequenza omologa (cDNA) 9Sequenza parzialmente omologa: - gene simile della stessa specie - stesso gene di un’altra specie 9Oligonucleotide (14-20 mer) degenerato sintetizzato chimicamente ottenuto per “traduzione inversa” di una corta sequenza proteica ¾ Sonde a DNA ¾ Sonde a RNA ¾ Marcatura terminale ¾ Marcatura interna ¾ Traccianti radioattivi ¾ Traccianti chimici Oligonucleotidi degenerati come sonde di ibridazione Si utilizzano quando: • non si conosce la sequenza nucleotidica del gene che si sta cercando • si conosce almeno parzialmente la sequenza della proteina codificata dal gene di interesse E’ preferibile costruire la sonda a partire da una sequenza proteica ricca in metionina o in triptofano Chromosome walking Un clone viene utilizzato come sonda per identificare i cloni immediatamente a monte e valle di esso. E’ utile per isolare e mappare un’intera regione genomica che si estende su più cloni. L’unico ostacolo è rappresentato dalla presenza di sequenze altamente ripetute nel genoma. Screening di genoteche per PCR E’ utilizzabile quando: • si conosce almeno in parte la sequenza nucleotidica del gene che si sta cercando • si conosce la sequenza della proteina codificata dal gene di interesse. In tal caso occorrono primer degenerati, utili anche per isolare membri di una famiglia genica i cloni non vengono trasferiti su supporto solido, ma in pozzetti di piastre microtiter. Più cloni possono essere trasferiti nello stesso pozzetto limitando il numero di amplificazioni da effettuare Sreening delle genoteche Sulla base della sequenza nucleotidica Ibridazione • cDNA • gene di specie diversa • sonda dedotta da seq. parziale proteina • chromos. walking Applicabile a tutte le genoteche Sulla base della struttura/funzione (vettori di espressione) • riconoscimento con Ab • interazione con ligandi • complementazione/acquisizione di funzione Applicabile alle genoteche di cDNA costruite con vettori di espressione Screening mediante Ab specifici Condizione necessaria per questo screening: • Disponibilità di un anticorpo contro la proteina codificata dal gene di interesse Condizione non necessaria per questo screening: • La proteina può anche non essere funzionale Screening per interazione: south-western, northwestern e interazione con ligandi alternativi Condizioni necessarie per questo screening: • La proteina deve essere funzionale • Il sito di legame per il ligando deve essere contenuto in un unico polipeptide Condizioni non necessarie per questo screening: • Non bisogna conoscere né la sequenza del gene né la sequenza della proteina • Non bisogna avere anticorpi a disposizione Il south-western è molto utile per identificare i fattori di trascrizione, attivatori e repressori che legano sequenze regolative come promotori, enhancers, ecc. Screening funzionale Condizioni non necessarie per questo screening: • Non bisogna conoscere né la sequenza del gene né la sequenza della proteina • Non bisogna avere anticorpi a disposizione Condizioni necessarie per questo screening: • La proteina deve essere funzionale • La funzione svolta dalla proteina deve essere testabile: 1. Analisi per acquisizione di funzione. La proteina conferisce alla cellula ospite un nuovo fenotipo (esempio: oncogeni umani sono stati identificati grazie alla loro capacità di stimolare la proliferazione di fibroblasti murini quiescenti. 2. Analisi medianti complementazione di funzione. Alcuni cloni di cDNA possono essere isolati per complementazione di un difetto genico portato dalla cellula ospite (in genere un batterio o un lievito). Questa analisi è applicabile solo per lo screening di attività enzimatiche molto conservate nel corso dell’evoluzione. Molti geni umani sono stati isolati sulla base della loro capacità di complementare mutazioni nei corrispondenti geni di lievito (esempi: geni codificanti enzimi metabolici, geni del ciclo cellulare. Clonaggio differenziale genoteche di sottrazione Screening di microarrays
Scaricare