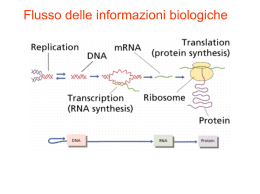
Separazione di frammenti di DNA (o RNA) di diversa lunghezza tramite elettroforesi Trasferimento secondo Southern (Southern blot) Non necessariamente i polimorfismi di restrizione (RSP) sono legati a mutazioni patogeniche, ma sono utili per caratterizzare alleli specifici Altra forma di ibridazione su membrana: lo slot blot (sia con campioni di RNA che di DNA) A B C D 1 1 2 3 4 2 5 6 7 8 3 9 10 11 12 4 13 14 15 16 Slot blot Altre forme di ibridazione: l’ibridazione in situ su cromosomi metafasici o interfasici (FISH-fluorescence in situ hybridization) Chromosome painting (verniciatura dei cromosomi) Sonda: insieme di sequenze ripetute caratteristiche di un cromosoma La FISH su cromosomi metafasici permette di evidenziare eventuali anormalita cariotipiche quali traslocazioni, duplicazioni o polisomie Sonda: grandi frammenti genomici (cloni di YAC, cosmidi o fagi) Altre forme di ibridazione: l’ibridazione in situ su sezioni di tessuto Campione: mRNA presente nelle diverse cellule del tessuto Sonda: filamento anti-senso di uno specifico RNA Trasferimento di RNA (Northern blot) • • • • Estrazione dell’RNA Separazione tramite elettroforesi su gel denaturante Trasferimento su membrana Promozione di legame covalente con la membrana (crosslinking) • Ibridazione con sonda specifica • Visualizzazione del segnale (autoradiografia o colorimetria) Quantificazione dell’RNA tramite Northern blot Autoradiography of Target ctrl RNA Gel colorato con etidio bromuro 1,990 37,500 11,300 49,100 1 0.24 5.0 41,200 51,850 10,890 Tecnica dell’ibridazione dell’RNA (Northern) • VANTAGGI: – Quantitativa – Provvede informazioni sul peso molecolare • SVANTAGGI: – Richiede molto lavoro e tempo – Relativamente poco sensibile – Limitata dalla capacita’ di legame della membrana • ALTERNATIVE: – RT-PCR – IBRIDAZIONE DI MICRO- O MACRO-ARRAYS Saggi di ibridazione standard e inversa • STANDARD:bersaglio non marcato legato a supporto solido, sonda marcata in soluzione – – – – Southern blot Northern blot Colony o plaque lift Ibridazione in situ su tessuto o su cromosomi • INVERSA: sonda non marcata legata a supporto solido, bersaglio marcato in soluzione – Microarray o macroarray di DNA – Microarray di oligonucleotidi Sia i macroarrays che i microarrays sono stati sviluppati per soddisfare l’esigenza di misurare contemporaneamente l’espressione di più geni. Entambe le tecnologie si basano sullo stesso principio: 1. Come sonda si usano olgonucleotidi o molecole di cDNA non marcati, immmobilizzati in posizioni precise di un supporto solido A B C D 1 a b g d 2 e z h q 3 i k l m 4 n x o Array p 2. L’array viene ibridizzato con una miscela complessa di molecole marcate rappresentative dell’mRNA espresso dalle cellule in esame mRNA RT Nucleotidi marcati cDNA Macroarray • Le molecole sonda vengono legate a membrane di nylon • Come tracciante viene utilizzata la radioattività • Analisi di qualche decina o poche centinaia di geni •Paragone tra l’intensita’ dei segnali ottenuti con campioni marcati diversi MICROARRAY A OLIGONUCLEOTIDI (tecnologia Affymetrix): •Le molecole sonda sono oligonucleotidi sintetizzati direttemente su microchip di silicio • Su ogni microchip vengono sintetizzati fino a 400000 oligonucleotidi diversi. •La metodica è stata sviluppata in modo da permettere misurazioni assolute dell’abbondanza dei singoli mRNA Microrray di cDNA (o di oligonucleotidi lunghi) • Le molecole sonda sono cDNA o oligonucleotidi lunghi 70-80 paia di basi, sintetizzati tradizionalmente e legati ad un vetrino da microscopio per mezzo di un processo di stampa a getto (spotting) • Su ogni vetrino trovano posto fino a 10000 geni. •Si effettuano misurazioni comparative, non assolute mRNA Reverse transcription Labeled 1st strand cDNA Sample 1 (test) Sample 2 (reference) Hybridization on the cDNA microarray Attenzione !!! L’enorme numero di geni analizzati dai microarray è il punto più forte, ma anche più debole della metodica. Infatti sono possibili moltissimi errori (importanza di avere campioni replicati), e il trattamento dell’informazione non è banale! L’acquisizione dei dati è solo la parte iniziale della procedura. La parte più complicata è l’elaborazione della enorme quantità di dati generati da questi esperimenti, necessaria per rispondere ai quesiti biologici di partenza. I dati più significativi devono essere poi verificati con altri sistemi (northern, real time RT-PCR) Applicazioni 1. Definizione delle basi molecolari e identificazione di nuovi markers prognostici per neoplasie e altre patologie 2. farmacogenomica Sequenziamento del DNA Metodo enzimatico (Sanger) Si eseguono 4 reazioni di polimerizzazione separate Sequenziamento del DNA Metodo enzimatico (Sanger) Amplificazione di una sequenza di DNA tramite la reazione polimerasica a catena (PCR) PCR VANTAGGI: • Sensibilita’ • Rapidita’ • Si presta all’analisi simultanea di molti campioni (high throughput) • Si presta all’analisi simultanea di diverse sequenze sullo stesso campione • Si presta all’analisi di DNA degradato o incluso in mezzi strani, o fissato • SVANTAGGI: • Sensibilita’ (rischio di contaminazioni-falsi positivi) • Variabile efficienza di amplificazione a seconda della sequenza • Richiede conoscenza di base delle sequenze da amplificare e messa a punto per coppie di oligonucleotidi di innesco (primers) • Può sintetizzare frammenti relativamente corti • La sintesi è imprecisa e introduce errori nella sequenza(la Taq pol non possiede attività 3’->5’ esonucleasica) Esempi di utilizzo della PCR • Su DNA: – segnalare la presenza o meno di sequenze specifiche (mutazioni, inserzioni virali, micro-organismo patogeni) -> PCR DIAGNOSTICA – Amplificare frammenti specifici da usare in seguito come sonde oppure da “clonare” • Su RNA messaggero (RT-PCR): – segnalare la presenza di specifiche molecole di RNA (espressione genica, presenza di RNA di micro-organismi infettivi) – Amplificare frammenti specifici da usare in seguito come sonde oppure da “clonare” - isolare cDNA specifici per determinati geni. PCR utilizzata per rivelare uno specifico mRNA: PCR in seguito a trascrittasi inversa (RT-PCR) • • • • Estrazione dell’RNA Purificazione dell’RNA poliadenilato (mRNA) Sintesi del cDNA con la trascrittasi inversa Amplificazione della sequenza di interesse con oligonuceotidi di innesto specifici • Analisi dei prodotti dell’amplificazione (elettroforesi) RT-PCR utilizzata per quantificare uno specifico mRNA • Reazione analizzata a compimento : – PCR non competitiva (semiquantitativa-controllo interno) – PCR competitiva (utilizza un competitore interno o MIMIC) • Reazione analizzata in tempo reale : – Utilizza l’amplificazione specifica con oligonucleotidi fluorogenici. L’amplificazione puo’ essere seguita mentre avviene, eliminando l’appiattimento dei risultati dovuto al raggiungimento della saturazione. L’intensita’ della fluorescenza misurata corrisponde alla quantita’ di prodotto amplificato. RT-PCR in tempo reale • Utilizza particolari combinazioni di coloranti fluorescenti accoppiati agli oligonucleotidi, la cui fluorescenza viene smascherata quando l’oligonucleotide e’ incorporato nella catena di DNA sintetizzata durante la reazione di amplificazione. • L’utilizzo di appositi apparecchi permette la misurazione della fluorescenza accumulata in tempo reale, proporzionale al numero di molecole amplificate e quindi al numero di molecole presenti in partenza I prodotti di PCR possono essere clonati: Uso della PCR per mappare, evidenziare e caratterizare mutazioni note o meno: • Amplicazione e sequenziamento delle sequenze codificanti un determinato gene • Rilevazione dei polimorfismi per i siti di restrizione • Amplificazione allele-specifica • Camminare lungo il genoma per individuare geni mutati La PCR può essere utilizzata per lo screening di mutazioni geniche, a partire sia da DNA genomico che da RNA La PCR può essere utilizzata per l’analisi di polimorfismi per i siti di restrizione (RFLP) Amplificazione allele-specifica (ARMS – amplification refractory mutation system) Chromosome walking:
Scaricare