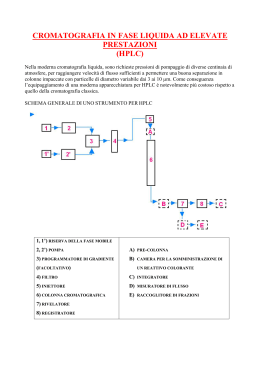
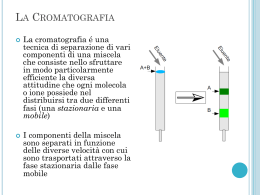
Cromatografia Fabrizio Papa Simulazione di una Cromatografia Poniamoci alcune domande: 1) Perché da una sostanza verde abbiamo ottenuto due sostanze, una gialla ed una blu? 2) Perché le due sostanze sono scese verso il basso? 3) Perché le due sostanze si sono separate? 4) Perché il volume occupato dalle sostanze è aumentato? 5) Perché la sostanza blu più trattenuta occupa un volume maggiore della sostanza gialla meno trattenuta? Un esempio Cerchiamo ora di individuare gli elementi della simulazione cromatografica e dell’esempio dei tipi chiacchierone e riservato ed abbinarli tra loro. Simulazione Tubo di vetro Sostanza blu Sostanza gialla Solido Solvente Esempio Tipo Violetto riservato Corso Folla Gambe Tipo rosa chiacchierone Cerchiamo ora di rispondere ad una domanda più difficile: Perché le bande si allargano? Per rispondere a ciò riprendiamo ancora l’esempio dei tipi chiaccherone e riservato. Perché si allarga la banda? Un esempio. 1 1 2 2 3 Intensità Cromatogramma 3 2 1 Tempo Non resta che cercare dei termini più appropriati per identificare gli elementi e gli eventi osservati e avremo definito tutto sulla cromatografia. Tubo di vetro Colonna cromatografica Solido Solvente Trascinamento del solvente Sostanze Fase stazionaria Eluente: fase mobile Eluizione Soluti Intensità Tempi di ritenzione tR = tempo di ritenzione t’ R tempo di ritenzione corretto K’ = (tR – t0)/t0 Fattore di capacità Kd = Cs/Cm Coefficiente di distribuzione t0 K’ = Kd*Vs/Vm Tempi Analizziamo ora l’ampiezza della banda: Intensità tR = tempo di ritenzione W1/2 H H1/2 W Tempo Analizziamo ora in maniera più scientifica perché la banda si allarga: Percorsi multipli Diffusione longitudinale Fase mobile Fase stazionaria In fase stazionaria Trasferimenti di massa In fase mobile stagnante Diamo dei valore ai tre contributi che influiscono sull’allargamento della banda Percorsi multipli = Diffusione longitudinale = A B Trasferimento di massa = O raggiungimento dell’equilibrio C HETP = A + B/v + C*v v = flusso Equazione di Van Deemter HETP = altezza del piatto teorico lunghezza della colonna = L n = L / HETP n = numero dei piatti teorici Un po’ di statistica Esempio: Una fabbrica produce dei prodotti (compresse) con 5 mg di principio attivo (caffeina) Vi chiedono di verificare se le compresse prodotte contengono effettivamente 5 mg di caffeina ed in caso contrario di valutare la variabilità. E voi cosa fate? 1) Le analizzate tutte? 2) Ne prelevate un po’ in modo casuale e le analizzate? Ne preleviamo 5 che danno il peso di 3, 4, 5, 6, 7 Media = 3+4+5+6+7 =5 5 La media non ci dice nulla sulla variabilità Proviamo con gli scarti dalla media 3 – 5 = -2 4 – 5 = -1 5–5= 0 3 – 5 = (-2)2 4 – 5 = (-1)2 Eleviamo al quadrato 5 – 5 = (0)2 6–5= 1 6 – 5 = (1)2 7–5= 2 7 – 5 = (2)2 somma 0 somma Quello che abbiamo ottenuto si chiama Devianza 10 Dividendo per il numero dei campioni o osservazioni o meglio per i gradi di libertà ci avviciniamo alla variabilità del singolo campione 10 5-1 = 2,5 Abbiamo appena ottenuto la Varianza Avendo prima elevato al quadrato ora possiamo fare l’operazione inversa con la radice quadrata 2,5 = 1,58 Abbiamo finalmente ottenuto la Deviazione Standard Riprendiamo i numeri appena analizzati 3, 4, 5, 6, 7 Un campionamento di cinque non è molto serio Facciamo un campionamento di 100 numeri approssimando i pesi a 0,5 Distribuzione dati Grafichiamo i dati su un istogramma 25 20 Distribuzione di Gauss 15 Serie1 Poli. (Serie1) La deviazione standard in una curva di Gauss è cade nel punto di flesso 10 5 La somma delle osservazioni tra –s e +s risulta essere il 68,2% 0 Serie1 3 3,5 4 4,5 5 5,5 6 6,5 7 1 4 12 21 24 21 12 4 1 Ancora un piccolo esempio: Due ditte producono due diversi prodotti: 1) Ha una media di 10 e s 2 2) Ha una media di 100 e s 2 Ci chiediamo qual è la ditta che lavora meglio, ovvero è più precisa, ovvero richiamando un termine cromatografico è più efficiente? La deviazione standard è uguale Proviamo a rapportare la deviazione standard alla media 2/10 = 0,2 Se moltiplichiamo per 100 otterremo 20 e 2 ovvero il Coefficiente di Variazione Percentuale o CV% 2/100 = 0,02 Questo ci dice chiaramente che la ditta che lavora meglio è la seconda s/ tR I valori di questo rapporto sono molto piccoli, prendiamo il reciproco tR/s O ancora meglio il suo quadrato (tR/s)2 N = (tR/s)2 1 deviazione standard equivale ad un’ampiezza di picco misurata a 0,882 di altezza, non facile da prendere e quindi si misura alla base che equivale a 4 deviazioni standard o a metà altezza che corrisponde a 2,354 s N =(tR/Wb /4)2 N =(tR/h1/2/2,354)2 N = 16(tR/Wb)2 N = 5,545(tR/h1/2)2 Equilibrio? Kd = Cs/Cm Kd = [fenolo]s/[fenolo]m Solvente = etile acetato Solido = silice Soluto = fenolo Estrazione con imbuto separatore, un processo all’equilibrio Kd = Cm/Cs Kd = [fenolo]H2O/[fenolo]CH2Cl2 La cromatografia non è un processo all’equilibrio Proviamo a riportare su grafico i tre contributi che tendono ad allargare una banda cromatografica HPTE C B A v = flusso La cromatografia ci permette di separare due o più sostanze Abbondanza Risoluzione tR Ancora sulla risoluzione Cattiva risoluzione Buona risoluzione dovuta all’efficienza della colonna Buona risoluzione dovuta alla selettività della colonna Risoluzione t r1 Dt t r2 R = 2 Dt/(W2 + W1) W1 W2 Efficienza Particelle di silice Bande lungo la colonna Cromatogrammi Selettività Cambiando la fase stazionaria Cambiando la fase mobile K’ = tR – t0 / t0 Kd = Cs / Cm Soluto A KdA Soluto B KdB A Fase mobile Fase stazionaria Cambiano i tempi di ritenzione B Parliamo di tipi diversi di cromatografia Classificazione in base alla fase mobile Liquida Gassosa Cromatografia su strato sottile in colonna, HPLC Gascromatografia in colonna A fluido supercritico Tra la cromatografia liquida e la gascromatografia, in colonna Cromatografia di assorbimento Fase mobile Siti attivi Fase stazionaria (solido) Un esempio di cromatografia di adsorbimento (fase inversa) Silice (Solido) Si OH HO O Si OH OH O Si O OH Si O OH O Si OH HO OH O Paradifenolo Ortodifenolo O O Cicloesano Etileacetato O Si OH Cromatografia di ripartizione Fase mobile Supporto solido Fase stazionaria (liquida) Un esempio di cromatografia di ripartizione (fase inversa) Silice (solido) Si O Si O Si O Si O Si O Si Fase stazionaria Catene C18 (liquido) Aldeide C7 N O H 40% 20% H H O 80% 60% Fase mobile Altre fasi stazionarie Si NC Si Si Si NC NC NC Si Si Si Si N N N N Cianoalchil Amminoalchil Si Si Si Si Si Fenilalchil O2N Si Si Si O2N O2N O2N Nitroalchil Cromatografia di esclusione Cromatografia di scambio ionico - + - + - ++ ++ + + + + + + + Gruppi scambiatori di ioni H3C OH - SO3 - H + CH 3 N CH 3 R Gruppo trimetilammonio Scambiatore di anioni R Gruppo solfonato Scambiatore di cationi Cromatografia di affinità Perché eseguire un’analisi cromatografica? Analisi qualitativa Analisi quantitativa Indicazioni per identificare una sostanza Quantificazione della sostanza Analisi qualitativa tR tR In generale sostanze diverse hanno tempi di ritenzione diversi Analisi Quantitativa h h Linea di base Linee di base corrette (da valle a valle) S = Base * Altezza/2 Totale = 1 + 2+ 3+ 2+ 1 Integrazione =9 Normalizzazione interna A B C ST = SA+SB+SC Il rivelatore risponde allo stesso modo con i vari componenti %A = SA/ST*100 %B = SB/ST*100 %C = Sc/ST*100 Ancora normalizzazione interna A B C Il rivelatore non risponde allo stesso modo con i vari componenti SA*fA/CA = SBfB/CB = SC*fC/CC fA = 1 fB = SA/CA*CB/SB S’A = SA * fA fC = SA/CA*Cc/Sc S’B = SB * fB S’C = SC * fC Stot = S’A + S’B + S’C CA= SA/STot CB= SB/STot CC= Sc/STot Taratura diretta A B POSSIBILITÀ DI DETERMINARE LA CONCENTRAZIONE DEL SOLO COMPONENTE CHE INTERESSA SS/CS = SC/CC CC=SC*CS/SS S = standard C = campione Standardizzazione esterna S Risposta Peso PA = peso del componente ricavato dal grafico %A=PA/PC*100 PC = peso del campione iniettato Standardizzazione interna SA/SI.S. PA/PI.S. QA = PA/PI.S.*QI.S. I st. II st. III st. Campione incognito Standard interno Sostanza da dosare Campione incognito 2 ml 2.000.000 = 0,5 4.000.000 1ml 1.000.000 = 0,5 2.000.000 Metodo dell’aggiunte multiple S Px Paggiunto CX=PX/VX
Scaricare