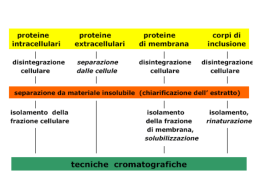
Le proteine si possono PURIFICARE sfruttando DIMENSIONE SOLUBILITA’ CARICA ELETTRICA AFFINITA’ PER ALTRE MOLECOLE L'invenzione della cromatografia viene attribuita al biochimico russo Mikhail Cvet che riuscì, nel 1906, a separare la clorofilla da un estratto vegetale. Con il termine cromatografia oggi si indicano tutte le varie tecniche separative e/o analitiche che si basano sulla distribuzione fra due fasi: una fase stazionaria (fissa) ed una mobile che passa attraverso la fase stazionaria. CROMATOGRAFIA Qualitativa Metodica separativa Quantitativa Preparativa Cromatografia liquida Gas Cromatografia Proteine Peptidi Acidi nucleici Biomolecole Vitamine e cofattori Carboidrati Lipidi Ogni singola molecola è contraddistinta da sue proprie e peculiari caratteristiche: Peso molecolare (ingombro sterico) Presenza/assenza di gruppi ionizzabili Presenza/assenza di regioni idrofobiche Struttura tridimensionale Solubilità in determinati solventi … E’ il metodo cromatografico maggiormente adoperato La fase stazionaria è immobilizzata su una matrice adatta (un supporto inerte ed insolubile) ed impaccata all’interno di una colonna di vetro o di metallo La fase mobile liquida è fatta passare nella colonna per gravità, tramite un sistema di pompe, oppure applicando gas sotto pressione Metodica Separativa I costituenti di una miscela vengono separati attraverso il passaggio in una colonna cromatografica… Colonna cromatografica FASE MOBILE FASE STAZIONARIA M Ripartizione delle molecole tra le due fasi FASE MOBILE FASE STAZIONARIA M Cosa determina la ripartizione tra le due fasi? 1) Le interazioni che si stabiliscono fra le molecole e le due fasi INTERAZIONI di TIPO NON COVALENTE Legami idrogeno Interazioni elettrostatiche Forze di van der Waals Interazioni idrofobiche 2) L’accessibilità differenziale alla fase stazionaria Dimensioni delle molecole Ripartizione differenziale delle molecole tra le due fasi FASE MOBILE FASE STAZIONARIA M1 M2 Perché e quando due molecole si separano? Perché le interazioni e/o l’accessibilità della molecola M1 con le due fasi (STAZIONARIA e MOBILE) sono diverse rispetto a quelle della molecola M2 FASE MOBILE FASE STAZIONARIA COO- COO- COO COO COO- COO Gruppi carbossilici immobilizzati (pKa: 4) PRGKKRGK 5+ / 1- GGILVFTEDD 1+ / 4H2O con tampone fosfato pH 7.4 Ripartizione differenziale delle molecole tra le due fasi Coefficiente di Distribuzione (K) K = [M]s / [M]m Nelle condizioni indicate precedentemente si può ritenere che: PRGKKRGK => K > 1 – alta “affinità” per la fase stazionaria GGILVFTEDD => K < 1 – bassa “affinità per la fase stazionaria GK KKR PRG COO- COO COO COO COO- COO Gruppi carbossilici immobilizzati (pKa: 4) GGILVFTEDD H2O con tampone fosfato pH 7.4 Ripartizione differenziale delle molecole tra le due fasi Coefficiente di Distribuzione (K) K = [M]s / [M]m FISSO nel TEMPO Sistema cromatografico fisso nel tempo FASE MOBILE e FASE STAZIONARIA non cambiano VARIABILE nel TEMPO Sistema cromatografico variabile nel tempo FASE MOBILE e FASE STAZIONARIA cambiano CROMATOGRAFIA di TIPO ISOCRATICA IN GRADIENTE L’entità delle interazioni che si stabiliscono tra le fase mobile e stazionaria e le molecole Rimangono invariate nel tempo Si modificano nel tempo K = [M]s/[M]m =1 Equilibrio Fase MOBILE Spostamento Equilibrio Spostamento Equilibrio Fase STAZIONARIA tempo K = [M]s/[M]m =1 FM FS FM FS K = [M]s/[M]m =4 Quantità assoluta I II III IV V I II III IV V Quantità assoluta Le molecole si separano grazie a differenze nella loro K K=4 Separazione K=1 Le colonne cromatografiche possono immaginarsi costituite da un certo numero di zone adiacenti in ognuna delle quali c’è spazio a sufficienza affinchè il soluto raggiunga un completo equilibramento tra fase mobile e stazionaria Ecco come il numero di piatti teorici influenza la distribuzione di un soluto con coefficiente di distribuzione pari ad 1 Un picco ben risolto non è l’equivalente di una sostanza pura A parità di volume di fase stazionaria, colonne più lunghe e strette determinano una separazione migliore (risoluzione) di proteine simili. Quando l’analita si muove in colonna, esso si distribuisce in una banda che presenta una distribuzione gaussiana In alcuni casi, però, il picco risulta asimmetrico, mostrando un allargamento sia della parte iniziale sia della parte finale (tailing) L’asimmetria dei picchi può essere dovuta a numerosi fattori Il caricamento in colonna di concentrazioni troppo elevate di analita L’imperfetto impaccamento della colonna La presenza di interazioni soluto-supporto Un’applicazione del campione mal eseguita Colonna Serbatoio per la fase mobile Dispositivo che consente l’identificazione degli analiti a mano a mano che essi lasciano la colonna nell’eluato Registratore Raccoglitore di frazioni La cromatografia liquida su colonna si divide in diversi tipi a seconda della pressione generata all’interno del dispositivo durante il processo di separazione Cromatografia liquida a bassa pressione (LPLC: low pressure liquid chromatography): le pressioni sono inferiori ai 5 bar (1 bar = 0.1 MPa) poiché la resistenza opposta dalla fase stazionaria (per la sua natura fisica) al flusso della fase mobile è minima Cromatografia liquida a media pressione (MPLC: medium pressure liquid chromatography): si generano pressioni tra 6 e 50 bar Cromatografia liquida ad alta pressione (HPLC: high pressure liquid chromatography): si lavora con pressioni superiori ai 50 bar Nella pratica le differenze tra MPLC ed HPLC sono insignificanti e vengono adoperate le stesse apparecchiature e procedure. Entrambe le tecniche forniscono un eccellente grado di risoluzione, per cui si preferisce definirle con il termine di cromatografia liquida ad alta risoluzione. Tempo di ritenzione (tR): tempo impiegato da ciascun analita per emergere dalla colonna Volume di eluizione o ritenzione (VR): volume di fase mobile richiesto per eluire l’analita I due parametri sono in relazione l’uno con l’altro tramite la velocità di flusso (Fc) della fase mobile in colonna: VR = tRFc La velocità di flusso dipende dalle dimensioni della colonna (diametro interno, lunghezza), dalle caratteristiche fisiche delle particelle che compongono la fase stazionaria (dimensioni, forma, porosità) e dalla viscosità della fase mobile. Generalmente si assume che l’area sottesa da ciascun picco sia proporzionale alla quantità dell’analita corrispondente che è stato eluito L’area del picco può essere calcolata misurandone l’altezza (hp) e la sua larghezza a metà dell’altezza (whA). Il prodotto di queste due dimensioni si assume essere pari all’area del picco. In alternativa, si può ritagliare il picco dalla carta del registratore e pesarlo, assumendo che area e peso siano linearmente correlati. I calcoli sono più efficacemente eseguiti da integratori appositi Matrici utilizzate SUPPORTO INERTE PER LA FASE STAZIONARIA Agarosio Polisaccaride cosituito da residui alternati di D-galattosio e 3,6-anidro-Lgalattosio. Disponibile commercialmente come Sepharose, Superose, Bio-Gel A Limiti di esclusione 10-40000 kDa Cellulosa Polimero di unita’ glucosidiche unite da legami β-1,4 (legami crociati tramite epicloridrina) Destrano Polimero di residui di glucosio uniti da legami β-1,6. E’ presente in commercio con il nome di Sephadex (legami crociati tramite epicloridrina). Limiti di esclusione 0.7-800 kDa. Il Sephacryl e’ costituito da destrano che forma legami crociati con N,N’-metilene bisacrilammide. Limiti di esclusione 1-8000 kDa. Il Superdex e’ un gel composito costituito da destrano covalentemente legato ad agarosio. Poliacrilammide Polimero di acrilammide e N,N’-metilenbisacrilammide. Disponibile in commercio come Bio-Gel P, limiti di esclusione tra 0.2 e 400 kDa Polistirene Polimero di stirene legato con divinilbenzene Silice Polimero prodotto a partire dall’ acido ortosilicico. I molti gruppi silanolo (SiOH) rendono la matrice altamente idrofilica IMPACCAMENTO DELLA FASE STAZIONARIA IN COLONNA Viene di norma eseguito introducendo con delicatezza in colonna (avendo cura di tenere chiusa l’uscita) una sospensione della fase stazionaria nella fase mobile Nel corso dell’impaccamento è necessario agitare la parte superiore della sospensione e/o tappare la colonna per assicurare che non rimangano bolle d’aria nella fase stazionaria La sospensione di fase stazionaria è versata in colonna fino a quando non viene raggiunta l’altezza desiderata A tal punto la colonna è messa in flusso con fase mobile aprendone l’uscita sino a completo impaccamento E’ opportuno posizionare sulla superficie della colonna un dispositivo di protezione adeguato, come un filtro di carta o una garza di nylon Nessuna parte della colonna deve essere lasciata andare a secco Un impaccamento insufficiente produce un flusso irregolare in colonna (channeling) ed una minore risoluzione CARICAMENTO DEL CAMPIONE Si rimuove dalla superficie della resina la maggior parte della fase mobile, aspirandola, e facendo flussare il rimanente in colonna. Il campione è poi applicato con una pipetta e fatto entrare in colonna. Un volume minimo di fase mobile serve infine a lavare le pareti della colonna dall’eventuale residuo di campione rimasto. Un volume più cospicuo di fase mobile è stratificato sulla superficie della colonna. In alternativa, la densità del campione può essere incrementata aggiungendovi saccarosio in concentrazione 1% circa. Quando questa soluzione è stratificata sul liquido che ricopre il letto della colonna, automaticamente si disporrà sul fondo ed entrerà rapidamente in colonna. La metodica è valida solo se il saccarosio non interferisce con la successiva separazione ed analisi del campione. Un terzo metodo prevede l’utilizzo di un tubo capillare e/o una siringa, oppure una pompa peristaltica per portare direttamente il campione sulla superficie della colonna. SVILUPPO DELLA COLONNA I componenti contenuti nel campione caricato sono separati l’uno dall’altro dal passaggio del solvente (fase mobile) nella colonna. E’ fondamentale che l’eluizione avvenga a velocità costante, ciò che è facilmente raggiunto eluendo per gravità. POMPE PERISTALTICHE Le pompe più comuni utilizzano tubi di silicone, polivinilcloruro o fluoruro che, compressi a velocità costante da un disco rotante, rilasciano la fase mobile con la velocità di flusso desiderata. Le pompe ed i tubi, di diametro noto, devono essere preventivamente tarati per determinare la velocità di flusso. ELUIZIONE ISOCRATICA Sviluppo della colonna con l’utilizzo di un solo solvente ELUIZIONE IN GRADIENTE Si operano variazioni continue di pH, concentrazione o polarità SISTEMI DI RIVELAZIONE La rivelazione può basarsi sull’assorbimento nella zona dell’ultravioletto, sulla spettroscopia a fluorescenza, su variazioni dell’indice di rifrazione, sull’emissione di radioattività. I sistemi di rivelazione più comuni registrano l’assorbimento di luce nell’ultravioletto. Gli strumenti migliori rivelano le proteine nell’intervallo 190 – 220 nm e 260 – 280 nm. RACCOGLITORI DI FRAZIONI Funzionano in modo tale da riempire ogni provetta con una certa quantità di eluato, prima di passare automaticamente a quella successiva. La quantità di eluato raccolta in ogni provetta può essere regolata in vario modo. Si può utilizzare un sistema di sifoni che convoglia un determinato volume, oppure un dispositivo elettronico che controlla il numero di gocce di eluato che cadono nella provetta. Una possibilità ulteriore di raccolta è quella ad intervalli fissi di tempo. Se varia la composizione dell’eluato, varia anche la tensione superficiale e la dimensione delle goccioline Se varia la velocità di flusso in colonna, varia anche il volume delle frazioni; in realtà ciò si verifica di rado e quindi i raccoglitori a tempo fisso sono i più utilizzati CROMATOGRAFIA Gel-filtrazione Scambio ionico Affinità Fase inversa FASE STAZIONARIA solida-porosa FASE MOBILE liquida solidagruppi carichi liquida solidaligando immobilizzato liquida liquida liquida/ gassosa Consente la separazione di molecole in base alle loro dimensioni Il termine gel filtrazione è, infatti, impiegato per descrivere la separazione di molecole di dimensioni diverse utilizzando gel (composti organici polimerici che possiedono una rete tridimensionale di pori che conferisce loro le proprietà di un gel) FASE STAZIONARIA FASE MOBILE solida – porosa liquida Nessuna interazione chimica tra le particelle di resina e le proteine Le particelle di resina fungono da setacci molecolari SI DISTRIBUIRANNO TRA LA FASE MOBILE ALL’ ALL’INTERNO ED ALL’ ALL’ESTERNO DEL SETACCIO MOLECOLARE E TRANSITERANNO IN COLONNA CON UNA VELOCITA’ VELOCITA’ INFERIORE SARANNO COMPLETAMENTE ESCLUSE DAI PORI E QUINDI PASSERANNO ATTRAVERSO GLI SPAZI INTERSTIZIALI E COMPARIRANNO PER PRIME NELL’ NELL’ELUATO Concentrazione proteica totale Attività Specifica N° della frazione (o volume dell’eluato) Se una molecola di analita è grande e perciò completamente esclusa dalla fase mobile presente all’interno del gel, il suo Kd è pari a 0, mentre se l’analita è sufficientemente piccolo da avere completo accesso alla fase mobile interna, il suo Kd è pari a 1 A causa della variabilità delle dimensioni dei pori tra le particelle di gel, solo una parte della fase mobile interna sarà accessibile agli analiti di dimensioni intermedie; quindi i loro valori di Kd variano tra 0 e 1 Ciò rende possibile la separazione su un determinato gel di analiti in un intervallo di dimensioni estremamente ristretto Nome commerciale Sephadex Bio-Gel Sepharose Polimero Intervallo di frazionamento (kDa) G-10 Destrano 0.05 - 0.7 G-25 Destrano 1-5 G-50 Destrano 1 - 30 G-100 Destrano 4 - 150 G-200 Destrano 5 - 600 P-2 Poliacrilammide 0.1 - 1.8 P-6 Poliacrilammide 1-6 P-10 Poliacrilammide 1.5 - 20 P-30 Poliacrilammide 2.4 - 40 P-100 Poliacrilammide 5 - 100 P-300 Poliacrilammide 60 - 400 6B Agarosio 10 - 4000 4B Agarosio 60 - 20000 2B Agarosio 70 - 40000 logPM Volume di eluizione Le colonne Sephadex G-25 possono essere utilizzate per dissalare soluzioni di composti ad alto peso molecolare Le sostanze ad alto peso molecolare sono escluse dai pori, mentre i composti a basso peso molecolare si muovono lentamente Tale metodo è adoperato per allontanare l’ammonio solfato da preparazioni proteiche ed i sali dai campioni eluiti dopo cromatografia a scambio ionico VANTAGGI • Semplice nell’esecuzione • Prevedibile • Eluizione nel tampone di partenza SVANTAGGI • Bassa capacità (piccoli volumi, 1/40 del volume della colonna) • Sovrapposizione dei picchi • Diluizione del campione Cellule di E. coli contenenti la RNasi A Lisi mediante ultrasuoni (sonicazione) Omogenato cellulare Centrifugazione (eliminazione detriti cellulari) Sopranatante dell’omogenato cellulare contenente la RNasi A Sopranatante dell’omogenato cellulare Cromatografia per gel filtrazione Resina SEPHADEX G-75 capacità di separazione 5-70 KDa Destrano: polimero di residui di glucosio uniti da legami β-1,6 che presenta legami crociati con epicloridrina. Limiti di esclusione 0.7-800 kDa. Pompa peristaltica Colonna Collettore di frazioni CONDIZIONI SPERIMENTALI Volume della resina: 12 ml Soluzione tampone: Tris-Acetato 0,1 M, pH 8,4, contenente NaCl 0,3 M Campione di carico (miscela di 4 proteine): 1. RNasi A (PM = 13.7 kDa) 2. α-amilasi (PM = 50 kDa) 3. Emoglobina da plasma bovino (PM = 64 kDa) (4 subunità da 16 kDa) 4. Albumina da siero bovino (PM = 69 kDa) Volume del campione di carico = 0,3 ml Volume delle frazioni = 0,4 ml Determinazione dell’assorbanza nell’ultravioletto (λ = 278 nm) di tutte le frazioni ottenute Riportando in grafico i valori di assorbanza in funzione del numero delle frazioni (o del volume eluito) si ottiene il cromatogramma Cromatogramma gruppo PLR Assorbanza a 278 nm 1,4 1,2 1 0,8 0,6 0,4 0,2 0 1 3 5 7 9 11 13 15 17 19 21 23 25 27 N° frazioni Cromatogramma Gaito-Pennacchio -Procentese Assorbanza a 278 nm 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 -0,1 0 5 10 15 N°frazioni 20 25 30 35 Cromatogramma Capuano Assorbanza a 278 nm 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 1 3 5 7 9 11 13 15 17 19 20 21 23 25 27 29 31 33 -0,1 N° frazioni Cromatogramma C.L. Assorbanza a 278 nm 1,4 1,2 1 0,8 0,6 0,4 0,2 0 -0,2 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 N° frazioni Le proteine si possono PURIFICARE sfruttando DIMENSIONE CARICA ELETTRICA • Le molecole cariche interagiscono con gruppi funzionali presenti sulla fase stazionaria • La forza del legame proteina-matrice dipende dalla carica netta della proteina • La separazione si basa sulle differenze di carica netta (per valori di pH definiti) delle diverse proteine • FASE STAZIONARIA FASE MOBILE • Le matrici adoperate possono essere di polistirene, cellulosa, destrano ed agarosio solida – gruppi carichi liquida Si basa sull’attrazione elettrostatica esistente tra proteine cariche e GRUPPI IONICI di carica opposta presenti sulla MATRICE Scambiatore cationico Scambiatore anionico Il meccanismo dello scambio ionico è definito in termini di cinque passaggi distinti: Diffusione dello ione sulla superficie di scambio Diffusione dello ione all’interno della matrice fino al sito di scambio Scambio degli ioni al sito di scambio Diffusione dello ione che è stato scambiato sulla superficie dello scambiatore Distacco selettivo della molecola di interesse 1. Variazioni di pH e/o di forza ionica 2. Eluizione per affinità → è introdotto nel sistema uno ione che presenta affinità maggiore per lo scambiatore rispetto allo ione legato Proteine con carica + Proteine con carica - - Scambiatore Proteine con carica + Proteine con carica - - - - - - - - - Scambiatore Proteine con carica + Proteine con carica - - - - - - CENTRIFUGAZIONE - Scambiatore Proteine con carica + Proteine con carica - - - - - - - - Soluzione di lavaggio - - - - - - - Soluzione salina concentrata - - - - - - - Eluizione - - - - - - - _ _ _ _ _ _ R-CH2-COOR-CH2-COO- + + + + + + R-CH2-COOR-CH2 _ _ _ _ _ _ -COO- R-CH2-COOR-CH2-COO- + + + ClNa+ R-CH2-COOR-CH2-COOR-CH2-COO- Na+ Na+ Cl- + + + + + + Cl- Na+ Na+ Cl- R-CH2-COO- Na+ Na+ R-CH2-COOR-CH2-COO- Cl- + + Cl+ Cl- Na+ Cl- Na+ Na+ Na+ R-CH2 -COO- Na+ R-CH2-COO- Na+ R-CH2-COO- Na+ R-CH2-COO- Na+ Cl- Na+ Cl- Cl- R-CH2-COO- Na+ Cl- R-CH2-COO- Na+ ClCl- Na+ Na+ Cl- Na+ Cl- + + + + + + Cl- ClCl- Cl- Cl- Cl- Cromatografia in batch - - - - - - - Cromatografia su COLONNA [SALE] [SALE] Effetti del pH sulla resina scambiatrice Gruppo CARBOSSIMETILICO scambiatore debole di cationi R-CH2-COOH = R-CH2-COO- pKa ~ 4.5 Gruppo PROPILSOLFONICO scambiatore forte di cationi R-CH2-CH2-CH2-SO3H = R-CH2-CH2-CH2-SO3pKa < 1 Effetti del pH sulla resina scambiatrice Gruppo amminico terziario scambiatore debole di anioni R | R-CH2-N: | R = R | R-CH2-NH+ | R pKa ~ 8.5 Ammina quaternaria scambiatore forte di anioni R | R-CH2-N+-R | R Effetti del pH sulla carica delle molecole proteiche pI = 5.5 Proteinan+ Proteinan- 4 7 10 pH Effetti del pH sulla carica delle molecole proteiche pI = 8.5 Proteinan+ 4 Proteinan7 10 pH Si definisce capacità totale di scambio il numero di milliequivalenti di ioni scambiabili, riferito ai grammi di scambiatore secco o all’unità di volume della resina idratata Elettroliti deboli, i quali sono ionizzati a valori estremi di pH, potranno essere separati solo su scambiatori forti, in grado di operare in un ampio intervallo di pH Per gli elettroliti forti si preferisce ricorrere a scambiatori deboli, i quali non sono in grado di legare le impurità fornite di carica presenti nel campione e possiedono caratteristiche di eluizione migliori Il pH del tampone adoperato deve essere di almeno una unità inferiore o superiore al punto isoionico dei composti da separare • Scambiatore cationico forte • pH 1-2 (tutti gli aa si legano) • Eluizione tramite aumento di pH e forza ionica: 1. 2. 3. • aa acidi (es. aspartato e glutammato) aa neutri (es. glicina e valina) aa basici (es. lisina e arginina) Rivelazione tramite ninidrina VANTAGGI • Possibilità di caricare grandi volumi • Eluizione della proteina di interesse in un piccolo volume SVANTAGGI • Esecuzione in due tempi • Eluizione in un tampone a pH e forza ionica diversi dal tampone iniziale • Possibilità di selezionare solo molecole ionizzabili Determinazione della concentrazione proteica mediante METODO DI BRADFORD Il colorante Coomassie® Brilliant Blue G-250 nella sua forma libera presenta un massimo di assorbimento a 465 nm (marrone) → il legame alle proteine determina uno spostamento del massimo di assorbimento del colorante a 595 nm (blu) La quantità di colorante che si lega è proporzionale alla quantità di proteine presenti nel campione in esame L’incremento di assorbanza a 595 nm (intensità del colore blu) è proporzionale alla concentrazione proteica COSTRUZIONE DI UNA RETTA DI TARATURA Proteina a concentrazione nota (BSA) Colorante (Bradford) 1 mg/ml 2 mg/ml 4 mg/ml 8 mg/ml 16 mg/ml Camp. H20 Camp. µl µl Bianco 500 Bradford µl Abs 595 nm M -- 500 0,423 0,453 0,438 ∆ 1 499 1 500 0,598 0,639 0,619 0,181 2 498 2 500 0,68 4 496 4 500 0,796 0,811 0,804 0,366 8 492 8 500 1,001 0,998 1,000 0,684 0,682 0,244 0,56 µg/ml y = 0,0511 x 0,45 Assorbanza a 595 nm 0,4 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 0 2 4 µ g di proteina 6 8 Camp. H20 µl Bianco 500 1 499 2 Camp. µl Bradford µl Abs 595 nm M ∆ 500 0,423 0,453 0,438 1 500 0,598 0,639 0,619 0,181 498 2 500 0,68 4 496 4 500 0,796 0,811 0,804 0,366 8 492 8 500 1,001 0,998 1,000 pool 490 10 500 #1 490 10 500 #2 490 10 500 #3 490 10 500 #4 490 10 500 0,684 0,682 0,244 0,56 µg/µ µl Le proteine si possono PURIFICARE sfruttando DIMENSIONE CARICA ELETTRICA AFFINITA’ PER ALTRE MOLECOLE Si basa sulla specificità delle interazioni biologiche per ottenere la separazione e la purificazione delle molecole Un ligando specifico per la molecola di interesse è legato covalentemente ad una matrice insolubile E’ necessario che le molecole da isolare siano in grado di legare il ligando in maniera specifica e reversibile FASE STAZIONARIA FASE MOBILE solida – ligando immobilizzato liquida • Deve possedere un numero sufficiente di gruppi chimici, ai quali possa essere legato covalentemente lo specifico ligando • Deve essere stabile nelle condizioni di legame e durante la successiva eluizione • Deve interagire solo debolmente con le altre macromolecole, riducendo così al minimo l’adsorbimento aspecifico • Le matrici più utilizzate sono i destrani (Sephacryl S), agarosio (Sepharose, Bio-Gel A), poliacrilammide (Bio-Gel P), polistirene (Bio-Beads S), cellulosa Per evitare che il legame del ligando alla matrice possa interferire con la sua capacità di legarsi poi alla macromolecola, è preferibile interporre un braccio spaziatore tra ligando e matrice La sua lunghezza è critica per l’efficienza della cromatografia (la lunghezza ottimale è tra 6 e 8 atomi di carbonio): 1) Se troppo corto può ostacolare il legame tra il ligando e la molecola da purificare 2) Se troppo lungo può instaurare interazioni idrofobiche con le molecole proteiche GENERICO: un ligando che mostri una selettività di gruppo, dal momento che è in grado di legare gruppi affini di molecole che possiedono una similarità chimica insita molto ampia, ad es. poly-(U) per mRNA SPECIFICO: un ligando che sia in grado di legare in maniera specifica una data molecola, ad es. un analogo di un substrato per purificare un enzima o ioni nickel per code di istidina Legame di un ligando al braccio spaziatore legato alla matrice L’immobilizzazione può provocare l’inattivazione del ligando perché ne altera la struttura tridimensionale o rende inaccessibile il sito di legame NON SPECIFICA: si basa su variazioni di pH, della forza ionica o sull’aggiunta di un agente denaturante SPECIFICA: si aggiunge un competitore, vale a dire un composto che ha una maggiore affinità per la molecola da purificare rispetto al ligando legato covalentemente alla matrice CROMATOGRAFIA DI AFFINITA’ per purificare una ribonucleasi pirimidina Analogo del substrato legato covalentemente alla resina o aggiunta del competitore VANTAGGI • Possibilità di caricare grandi volumi • Eluizione del composto di interesse in un piccolo volume • Elevata specificità di selezione SVANTAGGI • Esecuzione in più tempi • Richiesta conoscenza delle caratteristiche della molecola da selezionare (meccanismo d’azione, affinità per altri ligandi, ...) • Eluizione in un tampone a pH e/o forza ionica diversi dal tampone iniziale • In molti casi il campione eluito è contaminato dall’agente “spiazzante” Cromatografia per interazione idrofobica • PRINCIPIO: sfrutta l’idrofobicità superficiale delle proteine (residui Aa. non polari) • FASE STAZIONARIA: matrice inerte a cui sono legati gruppi idrofobici (radicali o gruppi ottilici, fenilici, butilici • FASE MOBILE tampone polare – A concentrazione salina decrescente (riduzione degli effetti idrofobici) – A concentrazione di detergente crescente – Con variazione di pH Cromatografia di ripartizione • Fase diretta • fase stazionaria: polare, • eluente apolare • Fase inversa • fase stazionaria apolare, • eluente polare Si – O – C18H37 Cromatografia liquido-solido o in fase normale FASE STAZIONARIA: Matrice di silica, allumina, fasi legate a GRUPPI amino-, ciano-, o fenilici FASE MOBILE NON POLARE Come esano, isopropanolo • Eccellente per analiti non polari,isomeri, separazione in gruppi omogenei in polarità Cromatografia in fase inversa Separazione basata sulla ripartizione • dell’analita in una fase stazionaria • idrofobica legata a gel di silice • FASE MOBILE polare come miscele di metanolo/acetonitrile e acqua; • Analiti polari eluiscono prima mentre i non polari sono più ritenuti • Modo HPLC più comune • Per analiti polari (solubili in acqua), di media polarità, e talvolta non-polari Interazione idrofobica • ELUIZIONE: • gradiente discendente di forza ionica • Gradiente ascendente di solventi organici (alcoli) • In alcuni casi il legame è così forte che si devono usare detergenti • UTILE PER LA SEPARAZIONE DI PROTEINE DI MEMBRANA High Performance Liquid Chromatography (HPLC) • Elevato numero di piatti teorici • Ridotta dimensione delle particelle di matrice • Elevata pressione della colonna Colonne per HPLC Pressione fino a 55 MPa (550 Bar)
Scaricare