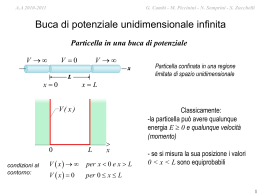
A.A 2010-2011 A.A. 2009-2010 G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini Modello atomico di Thompson secondo il modello di Thompson in un atomo la carica elettrica positiva e negativa è distribuita uniformemente in tutto il volume atomico Esperimenti di diffusione di particelle a su nuclei atomici particelle alfa, ossia nuclei dell’atomo di elio, sono collimate a formare un fascio che viene diretto contro una lamina d’oro vengono poi rivelate le particelle a diffuse dagli atomi della lamina secondo il modello di Thomson ci si aspetta che il fascio di particelle alfa incidente venga diffuso di qualche grado rispetto alla direzione di incidenza, ma sono assolutamente da escludere diffusioni all’indietro questo perche' i proiettili, ossia le particelle a, hanno massa pari a quattro volte la massa di un bersaglio, ossia la massa di un singolo protone o neutrone A.A 2010-2011 A.A. 2009-2010 G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini se i protoni ed i neutroni fossero distribuiti uniformemente all'interno del volume atomico, come vuole il modello di Thompson, l'urto avverrebbe tra un proiettile quattro volte piu' pesante del bersaglio lanciato contro un bersaglio praticamente fermo imponendo la legge di conservazione della quantita' di moto negli urti, in queste condizioni e' impossibile che il proiettili rimbalzi all’indietro sarebbe come se una palla da bowling lanciata a grande velocita' colpendo un birillo rimbalzasse indietro ! A.A 2010-2011 A.A. 2009-2010 G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini Esperimento di Rutherford : viceversa effettuando l’esperimento Rutherford constatò che si trovavano una grande quantità di particelle diffuse a grandi angoli , al limite anche all’indietro e questo mise in crisi la validita’ del modello di Thompson in effetti l’unico modo per poter spiegare questo risultato era di ammettere che la carica positiva fosse concentrata in un piccolo volume, il nucleo atomico, e che gli elettroni fossero diffusi attorni al nucleo in tutto il volume atomico in questo modo si spiega il perché delle diffusioni a grande angolo: se la particella a interagisce elettricamente direttamente un nucleo atomico può essere anche respinta all’indietro o comunque può facilmente subire deflessioni a grandi angoli, essendo la massa del nucleo molto maggiore della massa della particella incidente e' l'equivalente nel gioco del bowling di incollare tutti i birilli insieme uno all'alto, in questo caso la massa totale dell'insieme dei birilli diventerebbe paragonabile se non superiore alla massa della palla da bowling e diverrebbero possibili rimbalzi a grandi angoli di diffusione, al limite anche all'indietro A.A 2010-2011 A.A. 2009-2010 G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini da queste misure di diffusione o “scattering “ nacque il modello atomico “planetario” di Rutherford tuttavia se il modello di Rutherford da una parte risolveva il dilemma della distribuzione dei protoni all'interno del nucleo atomico, a sua volta originava altre problematiche : la prima questione e’ che i protoni sono caricati positivamente quindi come possono stare concentrati insieme strettamente nel nucleo atomico ? la forza di repulsione coulombiana dovrebbe essere enorme, di molto superiore alla forza di attrazione gravitazionale. Ma allora quale forza puo’ vincere questa repulsione e tenere “incollato il nucleo" ? la risposta, la forza nucleare, richiese quasi un secolo per essere formulata appieno e verificata sperimentalmente l'atomo di Rutherford poi, al contrario del modello di Thompson, pone il problema della stabilita' stessa della materia infatti nel modello "planetario" di Rutherford gli elettroni ruoterebbero attorno al nucleo come i pianeti intorno al sole A.A 2010-2011 A.A. 2009-2010 G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini la massa dell'elettrone e' pari a circa un millesimo di quella del protone, quindi gli elettroni non sono importanti dal punto di vista della massa, ma hanno carica elettrica, esattamente uguale ed opposta a quella dei protoni ed in quanto cariche accelerate dovrebbero irraggiare costantemente energia sotto forma di onde elettromagnetiche precipitando rapidamente sul nucleo atomico dunque l'atomo di Rutherford dovrebbe molto rapidamente decadere annichilandosi in un lampo di energia e.m. e questo chiaramente non e’ cio’ che avviene in natura infine il modello planetario dell’atomo non era in grado di spiegare gli spettri di assorbimento ed emissione degli atomi G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini A.A 2010-2011 A.A. 2009-2010 Spettroscopia : quando una radiazione elettromagnetica incide su di un atomo cede energia all’atomo e viceversa se ad un atomo e’ in qualche modo fornita energia, per esempio grazie agli urti con gli altri atomi, l’atomo si diseccita emettendo radiazione elettromagnetica in entrambi i casi classicamente ci si aspetterebbe un assorbimento di energia continuo da parte dell’atomo viceversa l’esperienza mostrava l’esistenza di spettri atomici di emissione ed assorbimento discreti per es.nell’atomo di idrogeno si ha l’emissione di righe spettrali che obbediscono alla legge : 1 R( 1 1 ) 2 2 n m dove m n 1 infine le righe spettrali non sono influenzate dagli urti che costantemente avvengono tra gli atomi o le molecole, in un gas si hanno circa 108 urti al secondo A.A 2010-2011 A.A. 2009-2010 G. CambiG.- M. Piccinini - N. Semprini - S. Zucchelli Cambi – S. Zucchelli – M. Piccinini Spettri di emissione Idrogeno (1e): Elio (2e): Mercurio (80e): Spettri di assorbimento gas luce Assorbimento selettivo schermo Spettro del Sole lo spettro solare è di assorbimento! A.A 2010-2011 A.A. 2009-2010 G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini Ipotesi di Bohr : l’atomo può esistere solo in determinati stati stazionari caratterizzati da energie discrete e può scambiare energia solo in quantità discrete che corrispondono alle differenza di energia tra uno stato stazionario, o livello, e il successivo o i successivi livelli possono quindi essere assorbite e/o riemesse quelle righe spettrali corrispondenti alle energie En Em hnnm ma quali sono le regole che governano l’emissione di questi quanti di energia ? G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini A.A 2010-2011 A.A. 2009-2010 Postulati di Bohr: • gli elettroni si muovono su orbite soggette alla condizione che il momento angolare sia un multiplo intero di ħ. Per orbite circolari: mvr = n • gli elettroni non irradiano energia quando si trovano in un'orbita stazionaria, definita dalla condizione precedente • l’atomo è in grado di emettere o assorbire energia solo quando l’elettrone si sposta da un orbita all’altra G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini A.A 2010-2011 A.A. 2009-2010 Quantizzazione del raggio dell’orbita v F = ma Ze2 mv 2 m x accelerazione centripeta Forza coulombiana 2 4π 0 r r ricaviamo: da cui: Ze 2 r 4π 0 mv 2 4π 0 quantizzando 2 a0 2 rn n n 2 mZe Z a0 2 4π 0 me 2 2 raggio di Bohr Ze 2 Ze 2 v 4π 0 mvr 4π 0 n G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini A.A 2010-2011 A.A. 2009-2010 Quantizzazione dell’energia 1 Ze 2 2 E mv 2 4πε 0 r dove Ze 2 mv 4πε 0 r 2 1 Ze2 Ze2 1 Ze2 E 2 4π 0 r 4πε 0 r 2 4π 0 r 1 En 2 me 4 Z2 Ze2 2 2 2 2 8ε 0 h n 4π 0 2 4π 0 n mZe2 ovvero: E n 13.607 Z2 n 2 eV e vista l’ipotesi che 4π 0 2 2 rn n 2 mZe G. Cambi G. - M. Piccinini - N. Semprini S. Zucchelli Cambi – S. Zucchelli – M. -Piccinini A.A 2010-2011 A.A. 2009-2010 h E n 1 E n 2 1 1 13 .6 2 2 n n2 1 eV in pieno accordo con i dati sperimentali ! n 2 n1 tuttavia : se da una parte l’atomo di Bohr risolve i problemi del modello planetario è ancora essenzialmente classico: gli elettroni sono particelle corpuscolari che si muovono classicamente intorno al nucleo e quindi non esiste una giustificazione fisica delle regole di quantizzazione di Bohr A.A. 2009-2010 G. Cambi – S. Zucchelli – M. Piccinini Backup Slides
Scaricare