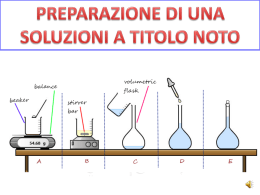
LEZIONE DI CHIMICA 16 Reazioni di neutralizzazione Soluzioni Molarità Concentrazione % p/p calcolistechiometrici Formazione sale NEUTRALIZZAZIONE uguale numero di cariche elettriche Ioni Me+ uguale numero Residuo alogenico SALE atomi di H da acido HCl + NaOH NaCl + H2O H2SO4 + 2 NaOH Na2SO4 + 2 H2O 2 H+ SO42- 2 Na+ 2 OH gruppi OH da idrossido nH n OH n H2O SOLUZIONI Miscugli omogenei soluto Particelle disperse tra le molecole del solido liquido gassoso solvente elettroliti sostanze idrossidi ioni In acqua idracidi covalenti polari ioniche ossiacidi sali dissociazione ionica idrolisi rottura legami covalenti formazione di ioni H O H H O H H Cl H solvatazione H O H H O H O H MOLARITA’ grammi sostanza numero moli soluto peso molecolare in grammi 1 litro soluzione 1 mol NaCl NaCl 1M 1 litro soluzione 200 ml soluzione 1M NaCl contengono M 1 mol NaCl 1 litro soluzione = x 0,2 litri soluzione V X= MV (in litri) CONCENTRAZIONE p/p % g soluto 100 g HCl 30% 100 g soluzione densità soluzione = d g/cm3 d= 1,1g/1cm3 Volume peso in grammi di 1 cm3 di soluzione 1oo g 1cm3 1,1o g volume di 100 g di soluzione 100 g/d CALCOLI STECHIOMETRICI reagente 3 HNO3 V1 =0,2 L M1 =0,1 M analita + Al(OH)3 sale acqua Al(NO3 )3 + 3 H2O V2 =0,12 L M2 =x dati n mol r = 1- completare e bilanciare la reazione 2- calcolare le moli di reagente (n mol r) nel volume dato 3- calcolare, in proporzione con i coefficienti stechiometrici, le moli di analita (n mol a) 4- calcolare la molarità (moli/1L) dell’analita V1 M1 n mol a/n mol r = 1/3 M2 = n mol a/V2
Scaricare