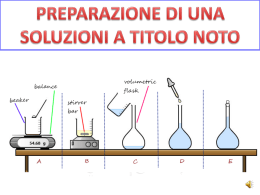
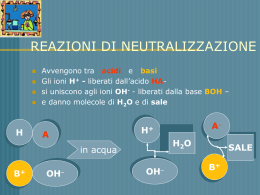
Elettroliti L’acqua non conduce la corrente elettrica (isolante). Soluzioni acquose di sali, composti costituiti da ioni, conducono la corrente elettrica. Le sostanze, come i sali, che in soluzione acquosa esistono in forma ionica sono detti elettroliti. Forti esclusivamente sotto forma di ioni ( sali come NaCl , K2CO3, etc.. e acidi forti o basi forti come HCl , HNO3 , NaOH ) Deboli parzialmente in forma ionica, parzialmente in forma di molecole neutre ( acidi deboli o basi deboli come HF, CH3COOH , NH3 ) Non elettroliti Na+ ClK+ F- esistono solo sotto forma di molecole neutre (glucosio) = Na+ ClK+ F- !,0 M NaCl 1,0 M NaF 1,0 M KF 1,0 M KCl Le due soluzioni sono identiche In entrambe le concentrazioni di Na+ , Cl- , K+ , Fsono identiche ( 1,0 M ) Unità formula Molecola del composto molecolare metano, CH4 Unità formula ( NaCl ) del composto ionico Cloruro di Sodio La molecola esiste come entità separata, mentre l’unità formula consiste in una coppia di ioni enucleata dal grande insieme ordinato di tutti gli ioni nel cristallo Soluzione acquose di un sale ( Na+ Br- ) Na + Br - Soluzioni di sali • NaCl(s) → Na+(aq) + Cl -(aq) • KNO3(s) → K+(aq) + NO3-(aq) • Na+ K+ Cl - NO3- • KCl(s) → K+(aq) + Cl -(aq) • NaNO3(s) → Na+(aq) + NO3-(aq) Equazioni ioniche nette (a) Ad una soluzione limpida di nitrato di piombo in una beuta si aggiunge una soluzione limpida di ioduro di potassio. (b) Si forma un precipitato giallo di ioduro di piombo. Gli ioni potassio e nitrato restano in soluzione (a) (b) Pb(NO3)2(aq) + 2 KI(aq) Pb2+ + 2 NO3- + 2 K+ + 2 IPb2+(aq) + 2 I-(aq) PbI2(s) + 2 KNO3(aq) PbI2 + 2 K+ + 2 NO3PbI2(s)
Scaricare