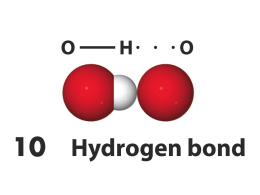
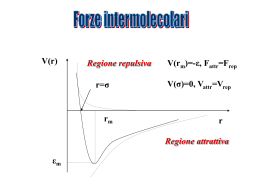
POLARIZZAZIONE DI LEGAME E DIPOLI CASI LIMITE IDEALI DEI TRE PRINCIPALI TIPI DI LEGAME CHIMICO 100% METALLICO Li Legame tra atomi ad elettroni delocalizzati condivisi da tutti gli atomi del reticolo cristallino Legame tra ioni dotati di carica elettrostatica (+,-) opposta Legame tra atomi in cui vengono condivise una o più coppie di elettroni di valenza H2 100% COVALENTE CsF 100% IONICO COVALENTE POLARIZZATO LEGAMI INTERMOLACOLARI Legami intermolecolari Interagendo molecole o ioni Sono coinvolte molecole polari ? NO NO Sono coinvolti ioni ? SI Sono coinvolte molecole polari e ioni ? SI Ci sono atomi di Idrogeno legati ad N, O, F ? NO Forze di London (dipoli indotti) Es.: Ar(l), I2(s) Forze di van der Waals NO Forze ione-dipolo Legame ionico Es.: KBr in H2O Es.: NaCl SI Forze dipolo-dipolo Legame a idrogeno Es.: H2S, CH3Cl SI Es.: H2O, NH3, HF LEGAME DIPOLO INDOTTO - DIPOLO INDOTTO Molecole non polari avvicinamento diventano polari per l’effetto attrattivo che il nucleo di una molecola esercita sulla nube elettronica di una seconda molecola in avvicinamento - + - + LEGAME DIPOLO - DIPOLO + - + + - + - - attrazione repulsione Glucosio O H H “ASINUS ASINUM FRICAT” ovvero il simile sgioglie il suo simile Vitamina idrosolubile Vitamina liposolubile LEGAME IONE - DIPOLO LEGAME IONE - DIPOLO LEGAME AD IDROGENO LEGAME AD IDROGENO Legami ad idrogeno nell’acqua Stato liquido Stato solido Clatrato Interazioni idrofobiche Diminuizione delle regioni di contatto tra molecole idrofobiche e molecole d’acqua Forze dipolo istantaneo – dipolo indotto (London) Punti di ebollizione di molecole o atomi apolari Elio He 4,2 K 2 e- Idrogeno H2 20 K 2 e- Neon Ne 27 K 10 e- Argon Ar 87 K 18 e- Kripton Kr 120 K 36 e- Xenon Xe 165 K 54 e- Radon Rn 211 K 86 e- Solubilità nell’acqua di composti contenenti O, N e F H H - N …….H - O H ammoniaca H CH3 - O ….H - O H alcol metilico Le vitamine idrosolubili possono fare legami H perché possiedono tanti gruppi OH solubili in acqua Zuccheri solubili in acqua perché hanno tanti gruppi OH fanno legami idrogeno H Biatomiche Polari Poliatomiche Apolari Apolari 1= Attorno HF HC l Legame covalente polare H2 O2 , N2 Legame covalente puro all’atomo centrale non ci sono doppietti liberi e 2= Gli atomi legati al centrale sono uguali Polari 1= Quando ci sono doppietti liberi sull’atomo centrale NH3 o 2= Quando gli atomi sono diversi tra di loro CHCl3 Tipo di Molecola Geometria Ax2 Lineare CO2 , BeCl2 Ax3 Triangolare Planare Bl3, BH3 Ax4 Tetraedro CH4 Ax3E Triangolare Piramidale NH3 Ax2E2 Angolare H2O LEGGENDA A= Atomo centrare X= Atomi Legati a Centrare E= Doppietti Liberi Disegno Esempio Tipo Particelle Forze Proprietà esempi molecolare apolare molecole London bassi p.f. e p.e. H2, CCl4 molecolare polare molecole London; H; dipolo p.f. e p.e. intermedi HCl, NH3 reticolo covalente atomi legame covalente elevati p.f.; solidi duri C, SiO2 ionico ioni legame ionico elevati p.f. NaCl, MgO Metallico cationi, e- mobili legame metallico p.f. variabile Na, Fe
Scaricare