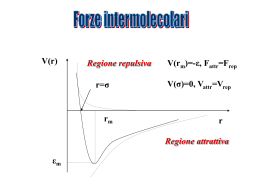
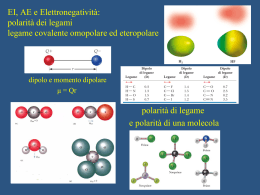
legame idrogeno in H2O Attrazione fra ioni • ioni di segno opposto si mettono vicino • l'energia diminuisce come 1/r (dove r e' la distanza fra 2 ioni) Interazioni ione-dipolo • idratazione degli ioni • l'energia diminuisce con r2 (r = distanza) • sono forti nel caso di ioni piccoli e di carica elevata • i cationi piccoli e molto carichi risultano spesso idrati anche nei composti Interazioni dipolo-dipolo • i dipoli si orientano nella direzione più favorevole • l'energia diminuisce con r3 Interazioni dipolo - dipolo indotto • un dipolo polarizza una molecola non polare • il dipolo indotto è sempre attrattivo per il dipolo permanente • l'energia diminuisce con r6 Interazioni Dipolo - Dipolo Interazioni Dipolo istantaneo – Dipolo indotto Forze di London Interazioni dipolo istantaneo - dipolo indotto • una molecola non polare può avere un dipolo istantaneo • questo dipolo induce dipoli nelle molecole vicine • i dipoli sono sempre orientati in modo attrattivo • l'energia diminuisce con r6 Polarizzabilità • i dipoli istantanei e indotti sono prodotti dallo spostamento degli elettroni • più sono gli elettroni, più grandi sono i dipoli e maggiore è l'attrazione • molecole grandi si attraggono (per forze di dispersione) più di molecole piccole Ambienti idrofili • ricchi di – dipoli – legami idrogeno – ioni • disciolgono – sostanze polari – sostanze che formano legami idrogeno – composti ionici Ambienti idrofobici • • • • ricchi di sostanze organiche non polari dominati da forze di London disciolgono sostanze non polari benzina, grassi
Scaricare