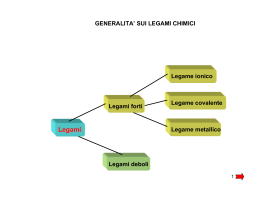
IL LEGAME CHIMICO IL Legame chimico Le interazioni che portano gli atomi a formare aggregati (specie chimiche) vengono dette legami chimici. Lo studio (e la conoscenza) del legame chimico è un problema di fondamentale importanza in chimica: infatti le reazioni chimiche (trasformazioni di determinate specie chimiche in altre specie chimiche) non sono altro che alterazioni (rottura e formazione) di legami chimici. Caratteristiche di un legame Elettronegatività Caratteristiche di un legame Elettronegatività Legame ionico Legame ionico Legame ionico Legame covalente Polarizzazione del legame covalente Polarizzazione del legame covalente e polarità delle molecole Polarità delle molecole poliatomiche Legame dativo Legame dativo Legame metallico Legame metallico Forze intermolecolari Sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli EF intermol.= 0.1÷10 KJ mol-1 Le forze intermolecolari si distinguono in: 1. interazioni di Van der Waals: interazione di natura elettrostatica che agiscono a corto raggio • • • forze di dispersione o di London interazione dipolo-dipolo interazione ione-molecola 2. legami a idrogeno Legame a idrogeno E’ un’interazione elettrostatica che si verifica nelle molecole che possiedono un atomo di idrogeno legato ad un atomo X molto elettronegativo e piccolo (X= F, O, N, Cl). L’atomo di idrogeno si trova ad avere un’alta densità di carica positiva e può attrarre l’estremità negativa di un’altra molecola
Scaricare