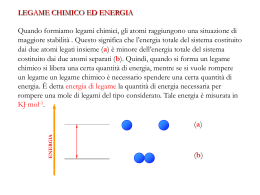
PAMELA GHIOTTO E GLORIA LOTTO CLASSE 1° C A.S GRUMOLO 2013-2014 L’ ATOMO Ogni materiale è costituito da molecole e atomi Gli atomi sono le unità più piccole della materia LA STRUTTURA DELL’ ATOMO L’ atomo è costituito da tre particelle Elettrone Neutrone Protone ELETTRONE L’ elettrone è una particella con carica negativa (-) Gira attorno al nucleo senza scappare perchè la sua carica negativa è attratta da quella positiva NEUTRONE L’ elettrone è una particella che non ha cariche ,ma ha solo massa Fa parte del nucleo ELETTRONI, NEUTRONI E PROTONI In un atomo il numero degli elettroni è uguale a quello di neutroni e protoni PROTONE Il protone è una particella con carica positiva(+) Fa parte del nucleo I LEGAMI Esistono tre legami: Ionico Covalente Metallico LEGAME IONICO Si definisce legame ionico la forza di attrazione elettrostatica che si stabilisce tra due ioni di carica opposta. Il legame ionico si forma tra atomi o gruppi di atomi tra i quali sia avvenuto uno scambio di elettroni Legame covalente Il legame covalente è un legame chimico in cui due atomi mettono in comune delle coppie di elettroni. Ciò avviene perché gli atomi tendono al minor dispendio energetico possibile ottenibile con la stabilità della loro configurazione elettronica. LEGAME METALLICO Il legame metallico consiste in una attrazione elettrostatica che si instaura tra gli elettroni di valenza e gli ioni positivi metallici TAVOLA PERIODICA DEGLI ELEMENTI CONFIGURAZIONE ELETTRONICA In chimica, il termine configurazione elettronica si riferisce alla disposizione degli elettroni legati, ossia al loro comportamento attorno ai nuclei di uno o più atomi LA TAVOLA DI MENDELEEV La tavola periodica è stata inventata da Mendeleev, un chimico russo che nacque l’ 8 febbraio 1834 e morì il 2 febbraio 1907 GLI ORBITALI ATOMICI Un orbitale atomico è una funzione che descrive il comportamento di un elettrone in un atomo L’ELETTRONEGATIVITA’ L'elettronegatività è una misura relativa della capacità di un atomo di attrarre elettroni quando prende parte a un legame chimico. TIPI DI LEGAMI LEGATI ALL’ELETTRONEGATIVITA’ Esistono tre tipi di legami rispetto all’ elettronegatività Polare Ionico Covalente LEGAME POLARE Quando la differenza tra le elettronegatività degli atomi che si legano e stanno tra 0 e 1,7 c’ è un legame polare LEGAME IONICO Quando la differenza tra le elettronegatività è superiore a 1,7 c’ è un legame ionico LEGAME COVALENTE Il legame covalente polare avviene quando c’ è una differenza di elettronegatività minore o uguale a 1,7
Scaricare