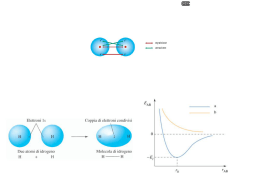
LEGAME CHIMICO ED ENERGIA Quando formiamo legami chimici, gli atomi raggiungono una situazione di maggiore stabilità . Questo significa che l’energia totale del sistema costituito dai due atomi legati insieme (a) è minore dell’energia totale del sistema costituito dai due atomi separati (b). Quindi, quando si forma un legame chimico si libera una certa quantità di energia, mentre se si vuole rompere un legame un legame chimico è necessario spendere una certa quantità di energia. È detta energia di legame la quantità di energia necessaria per rompere una mole di legami del tipo considerato. Tale energia è misurata in KJ. mol-1. ENERGIA (a) (b) Si possono distinguere tre tipi di legame con caratteristiche notevolmente diverse: nasce dalle forze elettrostatiche attrattive che si esercitano fra ioni di carica opposta in un solido ionico quale NaCl che è costituito da un reticolo di ioni Na+ e Cl legame covalente: è basato sulla condivisione degli elettroni di valenza da parte di due atomi. La forza di attrazione fra i due atomi deriva dalla attrazione di entrambi i nuclei degli elettroni condivisi. Un esempio è la molecola di H2 (o Cl2) in cui due atomi di H (o Cl) condividono i loro due elettroni. legame metallico: è basato sulla forza di coesione esercitata dagli elettroni di valenza liberi di muoversi attraverso un reticolo di cationi. Ad esempio in un solido metallico quale Na gli elettroni di valenza (uno per atomo) si muovono attraverso l'intero solido nel campo elettrostatico dei cationi Na+ legame ionico: LEGAME IONICO Il legame ionico è definito come : “l’attrazione elettrostatica di ioni di carica opposta”. Ioni che si generano per effetto dell trasferimento di elettroni da atomi elettropositivi (che tendono a cedere elettroni) ad atomi che tendono ad acquistare elettroni. Formazione del legame ionico nel cloruro di sodio (NaCl) 1 – L’atomo di sodio perde il suo elettrone esterno e diventa uno ione positivo. = Atomo di sodio (Na) Na Na+ + e- 2 – L’atomo di cloro acquista l’elettrone perduto dal sodio e diventa ione negativo. Cl + e- Cl- IL RISULTATO GLOBALE DEL TRASFERIMENTO DI UN ELETTRONE DALL’ATOMO DI SODIO ALL’ATOMO DI CLORO E’ LA FORMAZIONE DI DUE IONI, UNO POSITIVO ED UNO NEGATIVO, CHE SI ATTRAGGONO REALIZZANDO IL “LEGAME IONICO” VALENZA : NUMERO DI LEGAMI CHE UN ATOMO PUO’ FORMARE I sistemi per raggiungere la stabilità sono vari ma prevedono due meccanismi: trasferimento di elettroni (legame ionico) condivisione di elettroni (legame covalente) Tutti prevedono il coinvolgimento degli elettroni di valenza LEGAME COVALENTE: condivisione di una coppia di elettroni tra due atomi; gli elettroni provengono da tutti e due gli atomi e la condivisione può essere uniforme (legame covalente puro) oppure prevalente su uno dei due atomi (legame covalente polare) Un legame covalente è detto “puro” quando si forma fra atomi con lo stesso valore di elettronegatività, oppure valori molto vicini. In questo caso, gli elettroni che vengono messi in comune fra i due atomi vengono attratti con la stessa forza da entrambi i nuclei e, perciò, vengono ad essere condivisi in maniera uguale fra i due atomi (c’è una distribuzione simmetrica della nube elettronica). Esempi sono la molecola dell’idrogeno (H2) o del cloro (Cl2). IL LEGAME NELLA MOLECOLA DI IDROGENO H2 L’atomo di idrogeno ha solo un elettrone esterno e quindi spaiato. Il gas nobile più vicino all’idrogeno è l’elio (He), che ha due elettroni nel livello più esterno, cioè ha il primo livello energetico completamente occupato. L’idrogeno tende a raggiungere la configurazione dell’elio, cioè a trovare un modo per avere due elettroni nel primo livello. Se due atomi di idrogeno mettono in comune i loro elettroni, ognuno di essi avrà due elettroni, sia pure in comune con l’altro atomo. H H H H Formazione legame covalente H-H H separati, gli e- si appaiano formazione del legame Un legame covalente polare si forma tra atomi che hanno elettronegatività diversa, ma non tanto diversa da rendere possibile la formazione di un legame ionico (la differenza dei valori di elettronegatività è sempre minore di 1,7). I due atomi mettono in comune i loro elettroni spaiati, tramite la sovrapposizione degli orbitali in cui si trovano questi elettroni. Tuttavia la coppia di elettroni non è equamente condivisa fra i due atomi: gli elettroni passano più tempo attorno all’atomo più elettronegativo, rendendolo parzialmente (non c’è un trasferimento completo di una carica elettrica da un atomo all’altro, quindi non si formano ioni) negativo, mentre l’altro atomo diviene parzialmente positivo.
Scaricare