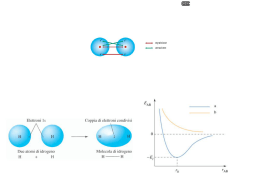
Legame chimico Ionico, covalente, metallico Gli unici atomi isolati presenti in natura sono i gas nobili Che hanno di speciale? In tutti l’ultimo livello ha gli orbitali p, e s, completi QUINDI Ultimo Livello con orbitali completi = stabilità Strategia di tutti gli altri elementi per raggiungere la stabilità Cercare di avere l’ultimo livello completo Come? UNENDOSI AD ALTRI ATOMI E FOMANDO MOLECOLE GLI ATOMI SI UNISCONO PER FORMARE MOLECOLE LEGAME CHIMICO PERCHE? Per avere maggiore stabilità energetica COME? Cercando di raggiungere la configurazione del gas nobile più vicino In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE STABILITA’ ENERGETICA attraverso un processo che porta alla formazione del LEGAME CHIMICO Ogni molecola può essere rappresentata nel modo più semplice attraverso una FORMULA CHIMICA, formata dai simboli degli elementi costituenti, che ne indica la composizione qualitativa e quantitativa. H2SO4 Nel legame chimico sono in gioco gli elettroni di valenza Ogni legame tra atomi coinvolge gli elettroni periferici, detti ELETTRONI DI VALENZA dell’atomo I SIMBOLI DI LEWIS SERVONO A RAPPRESENTARE GLI ELETTRONI DI VALENZA FORMALISMO SIMBOLICO DI LEWIS E’ un modo per Rappresentare gli elettroni di valenza. SI USA IL SIMBOLO CHIMICO DELL’ELEMENTO PIU’ UN PUNTINO PER OGNI ELETTRONE DI VALENZA. I puntini (rappresentanti gli elettroni) sono disposti ai quattro lati del simbolo atomico. Ciascun lato può contenere sino a due puntini (elettroni) H 1 2 Li Be Il numero degli elettroni di valenza corrisponde al GRUPPO di appartenenza nella tabella periodica degli elementi ELEMENTI DI TRANSIZIONE He 3 4 5 6 7 8 B C N O F Ne LA REGOLA DELL’OTTETTO Tutto in natura tende ad avere la minima energia, condizione nella quale si acquisisce la massima stabilità. In natura gli atomi isolati sono molto rari, perché non sono stabili A questa regola fanno eccezione i gas nobili, che sono invece elementi molto stabili La loro stabilità risiede nella loro configurazione elettronica esterna (He fa eccezione) nS2nP6 con gli orbitali S e P riempiti da 8 elettroni (un ottetto) La configurazione elettronica otteziale, conferendo la massima stabilità possibile, costituisce il riferimento che tutti gli atomi cercano di raggiungere attraverso le reazioni chimiche Tutti gli elementi reagiscono e formano legami per raggiungere la configurazione più stabile ovvero la configurazione elettronica esterna del gas nobile più vicino Come fanno gli atomi a formare i legami Cedono o acquistano elettroni da un atro atomo LEGAME IONICO Condividono elettroni con un altro atomo LEGAME COVALENTE Dipende dalla differenza di elettronegatività tra gli i atomi che formano il legame Un LEGAME COVALENTE si forma: • fra atomi uguali •Tra atomi che hanno una modesta differenza di elettronegatività (compresa tra 0 e 1,9) Gli atomi mettono in compartecipazione una coppia di elettroni in un orbitale che abbraccia entrambi gli atomi Se i due atomi hanno ELETTRONEGATIVITA’ COMPARABILE e la differenza fra le due è compresa tra ( 0-0,3): Gli ELETTRONI si LOCALIZZANO IN MEZZO ai due atomi Legame Covalente OMOPOLARE (PURO) Esempio: molecola di cloro Se i due atomi hanno ELETTRONEGATIVITA’ DIVERSA, MA NON TROPPO (D 0,3-1,7): Gli ELETTRONI si LOCALIZZANO IN MEZZO ai due atomi, ma un po’ SPOSTATI verso l’atomo più elettronegativo Legame Covalente ETEROPOLARE MAGGIORE E’ LA DIFFERENZA DI ELETTRONEGATIVITA’, PIU’ POLARE E’ IL LEGAME LEGAME IONICO si forma fra atomi che hanno una forte differenza di elettronegatività (superiore a 1,9) Uno o più elettroni passano all’atomo più elettronegativo Si forma uno IONE POSITIVO e uno IONE NEGATIVO che si attraggono Atomo di sodio e di cloro LEGAME IONICO CATIONE ANIONE Quando due atomi (un metallo e un atomo di un elemento degli ultimi gruppi) si avvicinano, gli elettroni del livello più esterno dell’atomo meno elettronegativo passano all’atomo più elettronegativo. Fra i due ioni con cariche elettriche opposte si stabilisce un’attrazione di tipo elettrostatico che li tiene uniti: Legame ionico. Basso potenziale di ionizzazione I composti ionici sono tutti SOLIDI a temperatura ambiente. Alta affinità elettronica Nel solido gli ioni si dispongono secondo un RETICOLO CRISTALLINO ordinato che permette di rendere massima l'attrazione tra le particelle di carica opposta e minima la repulsione tra quelle della stessa carica. Ad esempio nel reticolo cubico del NaCl ogni catione Na+ è circondato da sei anioni Cl- e viceversa. NaCl Hanno in genere punti di fusione elevati e punti di ebollizione ancora più elevati, per cui è difficile farli passare allo stato di vapore. Ciò indica che l’attrazione fra gli ioni è forte, per cui occorre molta energia per separarli. Legame metallico BASSA ENERGIA DI IONIZZAZIONE Gli e- sono attratti debolmente dai nuclei e sono liberi di muoversi Si forma il Reticolo cristallino In cui gli e- esterni sono DELOCALIZZATI La libertà di movimento degli elettroni è all’origine delle proprietà dei metalli: CONDUCIBILITA’ ELETTRICA CONDUCIBILITA’ TEMICA MALLEABILITA’ E DUTTILITA’ fine
Scaricare