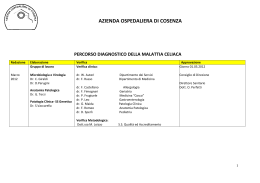
UPDATE MALATTIA CELIACA SIEROLOGIA DELLA MALATTIA CELIACA UNITA’ DI PATOLOGIA CLINICA AZIENDA OSPEDALI RIUNITI VILLA SOFIA-CERVELLO Direttore Dott: Tomaso Stampone Negli anni passati questa malattia veniva sospettata solo nei bambini che non crescevano. Negli ultimi anni, l’epidemia della celiachia ha assunto dimensioni inaspettate a livello globale, ed in molti paesi occidentali da malattia rara è divenuta una condizione molto diffusa, con un elevato impatto sociale essendo una malattia che dura tutta la vita se non si inizia una dieta priva di glutine. Recentemente si è visto che la M.C. in realtà è molto diffusa e subdola e può comparire in un periodo qualsiasi della vita con sintomi molto sfumati Nell’età adulta è caratterizzata dalla presenza di una combinazione variabile di manifestazioni cliniche associate o no ai sintomi gastro-intestinali Oggi si può affermare che i celiaci con il classico quadro di malassorbimento intestinale, caratterizzato da diarrea e perdita di peso, sono sempre più rari ad osservarsi, mentre predominano altri sintomi la stipsi ostinata, i dolori addominali, l’anemia sideropenica e l’osteoporosi. E’ una malattia cronica sistemica immunomediata indotta dall’ingestione di glutine che, in soggetti geneticamente suscettibili, determina un processo infiammatorio che porta a lesioni della mucosa dell’intestino tenue con conseguente malassorbimento e manifestazioni extraintestinali Glutine ingerito Genetica HLA II DQ2/DQ8 Antigliadina ( Ag esogeno ) Fattori di rischio (Sesso allattamento infezioni altro ) Anti transglutaminasi ( Ag endogeno) Anti endomisio ( Ag endogeno ) Malattia celiaca sistema nervoso cuore cute e cavità orale fegato sistema emopoiteco Organo bersaglio intestino tenue osso sistema riproduttivo femminile e maschile tiroide La celiachia è una malattia per cui l'ingestione di glutine (in particolare della proteina gliadina) determina un aumento della permeabilità epiteliale e contemporaneamente un’attivazione della transglutaminasi tissutale che ha un ruolo importante nell’innescare il disordine immunologico attraverso la deamidazione della gliadina che viene trasformata in peptidi ricchi di acido glutammico ad alta affinità per la tasca recettoriale HLA DQ2/DQ8 situate sulla superficie delle APC. Questi peptidi vengono processati dalle APC ed esposti sulla loro superficie stimolano i linfociti T CD4+ ( che una volta attivati iniziano a produrre citochine ) e i linfociti B ( produzione di anticorpi AGA, anti-tTG ed EMA ) MARCATORI SIEROLOGICI A partire dagli anni 80,grazie alla individuazione della patogenesi e la comparsa dei primi marcatori sierologici, il laboratorio è diventato componente fondamentale del percorso diagnostico della malattia celiaca Si tratta di analisi di laboratorio che prevedono un normale prelievo di sangue e che non richiedono alcuna specifica preparazione. Gli anticorpi appartengono alla classe IgA ed IgG, ma in generale solamente gli anticorpi di classe IgA possono essere considerati marker altamente sensibili e specifici per l’intolleranza al glutine. L’impiego dei marker di classe IgG e spesso fuorviante a causa dell’elevata percentuale di falsi positivi ed il loro uso dovrebbe essere limitato ai pazienti con deficit di IgA. , condizione strettamente associata alla celiachia. IgA che corrispondono al 20% delle immunoglobuline circolanti (immunità locale) IgA DEFICIENCY IgA……. IgM….. IgG…… IgA n.d. (alla nascita) 70-370 mg/dl (normal range) 60-260 mg/dl 700-1600 mg/dl 8-74( 3 mesi) 10-85 (1 anno) 60-270 (2-10 anni) Si osservano, molto spesso deficit parziali, ossia casi in cui la produzione anticorpale esiste, ma è in quantità insufficiente per l’età. SEROLOGICAL TESTS Tissue transglutaminase antibody (IgA-IgG) Endomysial antibody (IgA-IgG) Antibodies against deamidated gliadin (IgA-IgG) ANTICORPI ANTIGLIADINA- AGA Sono i primi anticorpi messi in evidenza nei soggetti con CD: sono Ab diretti contro un Ag esogeno, la alfa gliadina da glutine di grano. Nel siero dei soggetti con CD si trovano Ab AGA isotipi IgA e IgG. La determinazione delle IgA è utile nella diagnosi delle malattia in fase attiva e nel monitoraggio del comportamento alimentare dopo prescrizione della dieta priva di glutine. ANTIGLIADINA AGA IgA IgG (1967- 1970) (Dike 1950) ELISA Un tempo esame di elezione per la diagnosi di celiachia risultano positivi anche in altre patologie BASSA SENSIBILITA’ 70-90% E SPECIFICITA’ 82-92% METODICA ELISA Valori di riferimento Negativo Deb.positivo Positivo Unità <20 20-30 >30 Limiti della metodica legati alla scarsa specificità (rischio di falsi positivi) LA TRANSGLUTAMINASI TISSUTALE (tTG) Caratteristiche: Enzima ubiquitario Ca++dip. Amino-γ-glutamil-transferasi Peso molecolare: 78,24 k Catena aminoacidica: 689 aa Assenza di ponti di-solfuro Esistono diverse forme isoenzimatiche: Transglutaminasi 2 presente a livello della lamina propria dell’intestino tenue nei celiaci ANTITRANSGLUTAMINASI tTG IgA/ IgG (1997 W. Dieterick) E’ stata identificata come l'antigene più importante nella malattia celiaca. Gli anticorpi IgA anti-tTG sono dei marcatori sierologici altamente specifici per la malattia celiaca . Gli anticorpi IgG anti-tTG sono meno specifici, ma sono comunque un valido marker nei pazienti con deficit di IgA. METODICA : ELISA automatica risultati affidabili precisi quantitativi Valori di riferimento: Unità Negativo Deb.positivo Positivo <20 20-30 >30 TRANSGLUTAMINASITISSUTALE FONTI DI ANTIGENE Fonti naturali Tecniche ricombinanti Purificato da fegato Procarioti(E. Coli) di guinea pig Baculovirus / cellule eucariote di insetto Estratto da eritrociti umani 293-EBNA cellule renali embrionali Coltura di cellule d'insetto Spodoptera frugiperda (Sf9) infettate con baculovirus ricombinante a 48 ore dall'infezione I baculovirus sono una famiglia di virus in grado di infettare una grande varietà di artropodi ed in particolar modo le larve di Spodoptera frugiperda (Sf9) assumono un’importanza fondamentale nella pratica di laboratorio così come nell’industria, in quanto attraverso opportune modificazioni genetiche del loro genoma (baculovirus ricombinante) è possibile impiegarli come vettori di espressione per la produzione su larga scala di proteine ricombinanti. Figura 1 Profilo elettroforetico della tTG ottenuto con diverse tecnologie di produzione (Gelfiltrazione con 0.3 mg/ml di preparato proteico). La transglutaminasi ottenuta con la tecnologia DNA ricombinante eucariota Baculovirus/cellule di insetto presenta un profilo elettroforetico tipico di una proteina omogenea, in forma integra e priva di contaminazioni. La proteina ottenuta con le altre tecnologie di produzione presentano invece limiti o di integrità e/o di purezza. Detection of endomysial antibodies MONKEY EOSOPHAGUS ENDOMYSIAL Anticorpi Anti-Endomisio su esofago distale di scimmia ANTICORPI ANTI ENDOMISIO EMA ANTIENDOMISIO EMA (1983 Chorzelski) IFA Sono autoanticorpi diretti verso l’endomisio della muscolatura liscia dell’intestino. Il test degli anticorpi anti-endomisio, effettuato con la metodica dell’immunofluorescenza indiretta che utilizza come substrato antigenico l’esofago distale di scimmia o il cordone ombelicale umano e che rende visibile la reazione ANTIGENE-ANTICORPO marcando con la fluorescina o la rodamina. Al microscopio la positività degli EMA appre come una intensa fluorescenza a nido d’ape Viene attualmente utilizzato dalla maggior parte dei laboratori come test di conferma per i casi positivi per gli anti-tTG EMA Elementi critici della procedura Interpretazione soggettiva Utilizzo di substrati ottenuti da due particolari linee cellulari Metodica semiquantitativa ANTI-tTG EMA DGP-AGA Sono un nuovo interessante marcatore, avente una specificità talmente elevata (99%) un Valore Predittivo Positivo molto elevato da raggiungere quella degli EmA IgA e quella degli anti-tTG IgA I DGP-AGA, inoltre, si sono rivelati anche ottimi marcatori immunologici per individuare celiaci al di sotto dei due anni di età infatti sono rilevabili ancora prima rispetto alle IgA tTG. Deamidated gliadin peptide Nel primo tratto intestinale, ad opera dell’enzima transglutaminasi tissutale (tTG), la gliadina viene deaminata e trasformata in peptidi ricchi di acido glutammico ad alta affinità per la tasca dell’eterodimero DQ2. il legame tra i peptidi della gliadina deamidati e le APC è responsabile della risposta autoimmunitaria. O H2N NH2 O- O C C CH2 CH2 CH2 CH2 C C COOH H Gln H2N H Glu COOH Le cariche negative introdotte da questo processo di deamidazione aumentano l’affinità dei peptidi con la molecola DQ2. L’enzima transglutaminasi tissutale (tTG) a livello della mucosa intestinale attraverso un processo di deaminazione converte la glutammina ad acido glutammico. * Range di normalità <8 U/ml; zona cut-off (or zona intermedia) 5-8 U/ml Gliadina Deamidata (DGP) L’anticorpo di classe IgG (IgG DGP) è la vera novità In aggiunta alle tTG aumenta la nostra capacità diagnostica IgG DGP: – – – – Può essere impiegato nei deficit di IgA sia nei bambini che negli adulti unico esame utile da richiedere Può essere impiegato nei bambini al di sotto dei due anni di età come test aggiuntivo Il test Gliadina Deamidata IgG consente il recupero significativo dei cosiddetti “falsi positivi IgG DGP è un marcatore più tempestivo della aderenza alla dieta aglutinata in quanto gli anti tTg e gli EMA si negativizzano in ritardo Lewis&Scott. Deamidated gliadin and tTG compared as screening for coeliac disease. Aliment Pharmacol 2010 IgA – DGP IgA - tTG Sono anche disponibili test rapidi, eseguiti su goccia di sangue, per la ricerca degli anti-tTG. L’accuratezza diagnostica dei test rapidi è indubbiamente inferiore a quella dei marker sierologici tradizionali, per cui il risultato di questi test dovrebbe essere sempre controllato con la ricerca degli anti-tTG in ELISA. Si tratta di un test qualitativo (anticorpi sì - anticorpi no ) ALGORITMO DIAGNOSTICO Quali anticorpi devono essere utilizzati nello screening della celiachia? Un’altra importante pietra miliare nella storia della celiachia! CONGRESSO ESPGHAN 2011: 25-27 maggio 2011, Sorrento Da diversi anni un gruppo dell’ESPGHAN sta lavorando alla formulazione di più attuali criteri diagnostici, la cui validazione clinica dovrebbe concludersi a breve con la pubblicazione delle nuove linee guida. In accordo a tali criteri, la diagnosi di celiachia dovrà realizzarsi attraverso l’integrazione di dati clinici, sierologici, genetici, istologici, definire nuovi percorsi diagnostici più appropriati e richieste di esami più mirate In presenza del sospetto clinico di celiachia (soggetto con manifestazioni tipiche ed atipiche), si procederà al dosaggio delle IgA totali e alla ricerca degli anticorpi antitransglutaminasi. Sulla base del valore delle transglutaminasi, è possibile distinguere 3 scenari clinici SCENARIO CLINICO 1: in caso di forte positività degli anti-transglutaminasi (valori superiori a 10 volte i valori massimi di riferimento) in soggetti sintomatici, per confermare la diagnosi di celiachia sarà sufficiente riscontrare gli anti-endomisio e, mediante il test di tipizzazione genetica, un HLA compatibile (DQ2 o DQ8); in caso di negatività degli anti-endomisio e del test genetico, si dovrà riconsiderare la diagnosi; in caso di discordanza tra il risultato degli anti-endomisio e del test genetico, la biopsia intestinale sarà comunque necessaria. SCENARIO CLINICO 2: in caso di anti-transglutaminasi presenti a basso titolo (<10 volte rispetto al limite massimo dei valori di riferimento), i soggetti sintomatici dovranno comunque essere sottoposti all’esame endoscopico con biopsia intestinale per confermare il sospetto diagnostico. SCENARIO CLINICO 3: in caso di negatività degli anticorpi anti-transglutaminasi, la diagnosi di celiachia viene verosimilmente esclusa. In presenza di sintomatologia clinica molto suggestiva, il sospetto tuttavia rimane se: 1) c’è un contestuale deficit delle immunoglobuline della classe IgA – sempre da dosare insieme agli antitransglutaminasi in prima battuta-; 2) i soggetti sono bambini con <2 anni d’età; 3) c’è stata una scarsa assunzione di glutine nel periodo precedente l’esame; 4) sono stati assunti farmaci ad attività immunosoppressivi. Il futuro Standardizzazione dei test sierologici per potere eseguire uno screening di massa in bambini in età prescolare Diminuire il numero delle diagnosi basata sulla biopisia verso un approccio combinato che valorizza sempre di più la sierologia e la genetica La biopsia non scompare . Resta fondamentale nei casi non conclamati Necessità di un periodo per l’implementazione e la validazione delle linee guida che definiscano percorsi diagnostici più appropriati e condivisi nell’interesse e beneficio del paziente Realizzare un referto di laboratorio dove includere un commento esplicativo ed eventualmente la prescrizione degli esami necessari per il completamento dell’iter diagnostico Grazie per l’attenzione
Scaricare