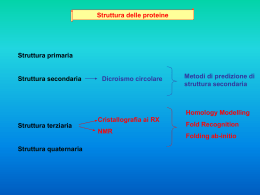
FONTI ALIMENTARI DELLE PROTEINE Alimenti con maggior contenuto di proteine ALIMENTO SOIA SECCA GRANA BRESAOLA PINOLI ARACHIDI TOSTATE PROSCIUTTO CRUDO SALAME FAGIOLI SECCHI PETTO DI POLLO TONNO FRESCO BOVINO ADULTO FILETTO MERLUZZO O NASELLO g proteine/100gr 36,9 33,9 32 31.9 29 28 27 23,6 23,3 21,5 20.5 17,0 Fonti di proteine (piatti unici) Buone fonti Fonti sufficienti Fonti povere Piselli novelli (200g) Riso integrale (200g) 1 carota Fagioli stufati (225g) Broccoli (100g) 1 mela Tofu (140g) Patate (200g) Panna densa (20g) Lenticchie (120g) - - Olio vegetale Nessuna Latte di soia (280ml) - - Zucchero o Nessuna sciroppo Muesli (60g) - - - - Uovo bollito - - - - Arachidi (30g) - - - - Pane (2 fette) - - - - Formaggio duro (30g) - - - - FONTI ALIMENTARI DELLE PROTEINE Le proteine di origine animale sono, dal punto di vista nutrizionale, più complete rispetto a quelle di origine vegetale in quanto contengono tutti gli aminoacidi essenziali. Per questo motivo vengono denominate proteine nobili o complete. Le proteine di origine vegetale sono invece carenti di uno o più aminoacidi essenziali e vengono chiamate incomplete o povere: chi non assume alimenti di origine animale (vegani o vegetariani) deve quindi combinare in modo opportuno diverse fonti di proteine vegetali, in modo da assicurarsi un apporto sufficiente per ogni aminoacido essenziale. FUNZIONI DELLE PROTEINE Le principali funzioni delle proteine sono: Funzione plastico-strutturale; Funzione regolatrice; Funzione di difesa immunitaria; Funzione energetica. Rivediamo la domanda n°3 e 5 del questionario iniziale FUNZIONE PLASTICO-STRUTTURALE Le proteine, costituenti principali delle cellule, hanno il compito di formare tessuti nuovi o riparare quelli preesistenti, per cui rappresentano il fondamentale materiale di costruzione per la cellula. Es.di proteine strutturali sono:elastina, collagene, actina e miosina FUNZIONE REGOLATRICE Le proteine regolano il metabolismo corporeo. Basti pensare agli enzimi e agli ormoni come l’insulina ed il glucagone(ormoni di natura proteica). FUNZIONE DI DIFESA IMMUNITARIA Tale funzione è svolta dagli anticorpi, proteine altamente specifiche nella difesa contro le infezioni microbiche FUNZIONE ENERGETICA Gli amminoacidi introdotti in eccesso con la dieta sono avviati o verso processi metabolici che consentono la produzione di energia o vengono trasformati in altri composti per la sintesi di nuove molecole. L’energia prodotta da 1 grammo di proteine è pari a 4 Kcal. FABBISOGNO PROTEICO 30% LIPIDI 55% CARBOIDRATI 15 % PROTIDI 10% ORIGINE ANIMALE 5% ORIGINE VEGETALE Per chi pratica sport in modo intenso il fabbisogno di proteine può aumentare anche fino al 20% delle calorie totali giornaliere. Tralasciando il body building che è un caso piuttosto particolare, la pratica di uno sport di resistenza (come la corsa o il ciclismo) determina un incremento significativo del fabbisogno proteico. I muscoli infatti, a causa dello sforzo prolungato, devono essere "ricostruiti" più frequentemente. FATTORI DA CUI DIPENDE IL FABBISOGNO PROTEICO Massa corporea Il fabbisogno di proteine è proporzionale alla massa corporea;si esprime infatti, in grammi per kilogrammi di peso corporeo. In generale per una persona adulta il bisogno di proteine è pari a: 1g per ogni kg di peso corporeo Età e condizioni fisiologiche particolari Il fabbisogno proteico aumenta in ogni condizione fisiologica che richiede la costruzione di tessuti nuovi. Esempi sono la crescita, la gravidanza,l’allattamento,lo sport,situazioni di trauma osseiarticolari( fratture ecc). In questi casi si consiglia un apporto proteico di 1,5g per ogni kg di peso corporeo Apporto energetico della dieta Se l’apporto energetico è adeguato, le proteine introdotte con la dieta vengono utilizzate per fini plastico-strutturali. In caso contrario le proteine possono essere utilizzate per scopi energetici. Qualità delle proteine alimentari La qualità nutrizionale delle proteine è in relazione al loro valore biologico,per cui la quantità di amminoacidi limitanti condiziona la sintesi di proteine. Le proteine degli alimenti sono importanti in quanto forniscono gli amminoacidi necessari per la sintesi delle proteine corporee. Rivediamo la domanda n°1 del questionario iniziale CHIMICA DELLE PROTEINE •composti quaternari formate da C, H, O, N •sono MACROMOLECOLE costituite a partire da AMMINOACIDI H idrogeno R catena laterale (parte variabile) C NH2 gruppo amminico COOH gruppo carbossilico ESEMPI DI AMMINOACIDI GLI AMMINOACIDI AMMINOACIDI AA ramificati ESSENZIALI Leucina, isoleucina,valina AA aromatici Fenilalanina,triptofano AA solforati Metionina AA polari Lisina,treonina,istidina, arginina NON ESSENZIALI Glicina, Alanina,Asparagina, Glutammina Cisteina, Prolina, Serina Aspartato, Glutammato,Tirosina Ma perché essenziali? Tali amminoacidi sono detti essenziali in quanto il nostro organismo non è in grado di produrli e quindi è costretto ad assimilarli solo dagli alimenti. Gli amminoacidi sono legati attraverso il legame peptidico. Aminoacido (1) Aminoacido (2) H NH2 C COOH R Condensazione Legame peptidico Rivediamo la domanda n°2 del questionario iniziale Acqua La reazione inversa, cioè la rottura del legame peptidico,avviene in presenza di acqua e viene definita proteolisi o idrolisi proteica STRUTTURA DELLE PROTEINE struttura primaria rappresenta numero ,tipo e sequenza lineare degli aa. Determina le successive strutture proteiche, consentendo l’instaurarsi di forze intermolecolari tra i diversi punti della catena polipeptidica struttura secondaria configurazione spaziale delle proteina struttura terziaria rappresenta l’ulteriore ripiegamento spaziale della catena polipeptidica struttura quaternaria è prodotta dall’unione di più catene polipeptidiche dette subunità E’ importante in quanto determina la funzione e l’attività biologica di una proteina Tra gli amminoacidi della struttura primaria si instaurano legami idrogeno che ne provocano la torsione (es. a-elica:proteine fibrose come la cheratina) E’ prodotta dall’interazione tra amminoacidi posti in punti diversi della struttura secondaria (es. proteine globulari come l’emoglobina) Il livello di organizzazione superiore di queste proteine, consente loro di svolgere attività biologiche complesse (es.enzimi come la lattasi) CLASSIFICAZIONE DELLE PROTEINE Esse si classificano in base a: FORMA FUNZIONE COMPOSIZIONE CHIMICA VALORE BIOLOGICO FORMA PROTEINE FIBROSE hanno forma allungata e svolgono maggiormente una funzione strutturale o meccanica. Le ritroviamo in tessuti che richiedono resistenza come unghie e capelli(cheratina) o elasticità come il muscolo( actina e miosina) PROTEINE GLOBULARI sono compatte e di forma sferoidale. Sono globulari le proteine di trasporto, gli enzimi e gli ormoni FUNZIONE Proteine di trasporto:che veicolano ad es ossigeno(emoglobina) o lipidi (lipoproteine) Proteine strutturali :rappresentano componenti fondamentali della struttura di organi o tessuti (collagene) Proteine con funzione di ormoni: controllano i processi metabolici (insulina e glucagone) Enzimi Proteine contrattili: consentono la contrazione muscolare (actina e miosina) Proteine per la difesa immunitaria: gli anticorpi che rappresentano un sistema di difesa specifico per il nostro organismo COMPOSIZIONE CHIMICA Proteine semplici: composte da soli amminoacidi Proteine coniugate: costituite dall’unione di un gruppo non proteico e da una parte proteica( es lipoproteine insieme di una proteine ed un lipide;glicoproteine insieme di una proteina e un glucide) VALORE BIOLOGICO Le proteine possono essere classificate, da un punto di vista nutrizionale, in base al contenuto di amminoacidi essenziali(aae). L’uomo necessità di una precisa quantità di proteine al giorno,che ricava dai diversi alimenti come miscela di amminoacidi. Basta che un solo aae non sia sufficientemente presente in questa miscela proteica,da impedire il normale utilizzo di tutti gli altri amminoacidi. L’amminoacido essenziale presente in minore quantità nella miscela proteica è detto amminoacido limitante perché limita il normale utilizzo della proteina da parte dell’organismo. In base a quanto detto ,le proteine si classificano in: Proteine ad alto valore biologico: sono proteine complete perché contengono, in modo equilibrato, tutti gli aae . Alimenti che contengono proteine complete sono ad es le uova, la carne, il pesce,il latte e i suoi derivati. Proteine a medio valore biologico: sono proteine parzialmente complete con un contenuto in aae non equilibrato dal punto di vista nutrizionale. Alimenti contenenti proteine del genere sono ad es i legumi. Proteine a basso valore biologico: sono proteine incomplete in quanto carenti di alcuni aae. Le proteine dei cereali sono incomplete perché non contengono lisina(aae). Cos’è, quindi, il valore biologico di una proteina? Valore biologico delle proteine presenti in alcuni alimenti Rappresenta un valore (in %)che esprime la quantità di proteine assimilata dall’organismo rispetto alla quantità totale di proteine ingerite. Alimenti Valore biologico Uova 94 Albume d’uovo 91 Latte 90 Pesce 90 Carne di bue 76 Patate 70 Riso 67 Spinaci 64 Farina di frumento 42 E’ buona norma quindi garantire un’alimentazione equilibrata che consenta di giungere ad una certa COMPLEMENTARIETA’ DELLE PROTEINE contenute negli alimenti. Ad es è auspicabile abbinare,in un pasto, cibi contenenti proteine incomplete di alcuni aae ed altri carenti in altri aae, così da migliorare il valore biologico delle proteine carenti. Combinazioni tipiche sono rappresentate da tipici piatti mediterranei come pasta e fagioli, riso e lenticchie. Pasta Fagioli aa solforati lisina Si No No si Rivediamo la domanda n°4 del questionario iniziale GLI ENZIMI Sono proteine con funzione catalitica, cioè capace di aumentare la velocità delle reazioni biologiche rimanendo inalterate alla fine del processo Un catalizzatore è una sostanza che non partecipa direttamente alla reazione chimica (si trova nella stessa quantità prima e dopo la reazione stessa), ma la accelera o la rende possibile in condizioni ambientali più favorevoli. Ad esempio la scissione del glucosio richiede una temperatura di 100° e tempi lunghissimi,mentre gli enzimi permettono una rapida reazione all’interno del corpo umano. Caratteristica fondamentale degli enzimi Specificità tra l’enzima e: la molecola da trasformare (substrato) le sostanze ottenute al termine della reazione (prodotti) Es. la pepsina (enzima) agisce sulle proteine (substrato) fornendo peptidi (come prodotti); oppure la lattasi(enzima) agisce sul lattosio( substrato) liberando glucosio e galattosio ( prodotti) Enzima Peptidi Substrato Prodotti Proteine Pepsina Complesso enzima/substrato LA DENATURAZIONE PROTEICA PROTIDI DENATURAZIONE Agenti chimici (acidi o basi), agenti fisici (alte T o azione meccanica persistente) modificazione della struttura secondaria, terziaria o quaternaria senza rompere i legami peptidici. La perdita della configurazione nativa comporta cambiamenti nelle caratteristiche fisiche della sostanza e la perdita dell’attività biologica DAL CRUDO AL COTTO…. Con la COTTURA gli alimenti diventano più.. •appetibili modifica aspetto, colore, sapore •masticabili e digeribili a seguito di reazioni chimiche •commestibili inattiva sostanze antinutrienti •igienicamente più sicure uccidendo microrganismi patogeni La denaturazione in cucina….. L’uovo al tegamino… Le meringhe… La marinatura..una carne che si scioglie in bocca… DIGESTIONE DELLE PROTEINE STOMACO Le ghiandole gastriche producono pepsina e acido cloridrico necessario alla sua attivazione , visto che questo enzima è secreto in forma inattiva( pepsinogeno). La pepsina scinde il legame peptidico delle catene proteiche portando alla formazione di polipeptidi di diversa grandezza. INTESTINO TENUE Le proteasi pancreatiche come tripsina,chimotripsina, carbossipeptidasi, demoliscono poi i polipeptidi giunti dallo stomaco,riducendoli a frammenti proteici. Le peptidasi, secrete dalle ghiandole intestinali, agiscono poi su questi frammenti formazione di un “pool” di amminoacidi liberi. Gli amminoacidi cosi liberati, vengono assorbiti dai villi intestinali, giungendo poi al fegato tramite la vena porta,dove vengono poi utilizzati per i diversi processi metabolici METABOLISMO proteine Insieme delle reazioni chimiche e fisiche che avvengono in un organismo o in una sua parte. Il metabolismo si divide in due insiemi di processi: anabolismo, che produce molecole complesse a partire da molecole più semplici; catabolismo, che comporta la degradazione di molecole complesse in molecole più semplici Il metabolismo umano, come i metabolismi di tutte le specie altamente evolute, è molto complesso e consiste in decine di migliaia di processi biochimici, maggiormente mediate da specifici enzimi. Turnover proteico All'interno dell'organismo le proteine sono soggette ad un ricambio continuo detto turnover. Quelle "vecchie" vengono frammentate(catabolismo) e sostituite con la sintesi(anabolismo) di nuove proteine. Gli aminoacidi necessari per la sintesi delle proteine derivano sia dalle proteine alimentari, sia da quelle organiche. aa provenienti dalla dieta aa provenienti dal catabolismo Pool di amminoacidi della cellula sintesi di nuove proteine aa avviati alla sintesi di altre sostanze ELIMINAZIONE DELL’AZOTO Il catabolosmo degli aa porta all’eliminazione dell’azoto a seguito dell’eliminazione del gruppo amminico (-NH2) che porta alla formazione di ammoniaca (NH3), un composto tossico per le cellule.Essa deve quindi essere trasformata in urea in un processo che ha luogo nel fegato denominato ciclo dell’UREA. L’urea è poi eliminata attraverso l’urina. H R C NH2 COOH
Scarica