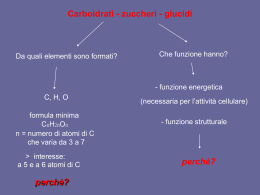
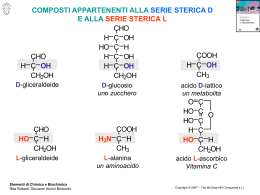
Il nome deriva dall’arabo sukkar, divenuto in greco sàkkharon e in latino saccharum, da cui il termine «saccaridi» come sinonimo di zuccheri. Vengono anche indicati come glucidi (dal greco glucòs=dolce) CxH2yOy oppure Cx(H2O)y Hanno formula grezza generale Per quest’ultima formula si indicano anche come idrati di carbonio (carboidrati) In base alla grandezza molecolare si classificano in: Monosaccaridi (zuccheri semplici, formati da una unità molecolare) Oligosaccaridi (formati dalla polimerizzazione da 2 a 10 unità) Polisaccaridi (formati da lunghe catene di monosaccaridi) La IUPAC li definisce poliidrossialdeidi e poliidrossichetoni in quanto la molecola presenta un gruppo funzionale aldeidico -CHO oppure chetonico C=O e tanti gruppi ossidrili –OH quanti sono i restanti atomi di carbonio. Gruppo carbonilico In base alla posizione del gruppo carbonilico C=O si classificano in monosaccaridi chetosi o monosaccaridi aldosi Per il nome IUPAC si usa il suffisso -oso (oppure -osio). Sono indicati generalmente anche in base al numero totale di carboni. Ovviamente esistono i corrispettivi chetosi I monosaccaridi più piccoli Centro chirale 2,3-diidrossi propanale 1,3-diidrossi propanone Prodotti intermedi nel metabolismo dei carboidrati Gli aldosi con almeno 3 atomi di carbonio ed i chetosi con almeno 4 atomi di carbonio contengono centri chirali. Per ogni centro chirale esistono due isomeri ottici (L e D) in totale 2n isomeri, dove n=numero di centri chirali. La nomenclatura IUPAC di queste molecole deve specificare, per ogni centro, l’isomero specifico. 2(R),3(R),4(R),5 -tetraidrossipentanale 2(S),3(R),4(R),5 -tetraidrossipentanale 2(R),3(S),4(R),5 -tetraidrossipentanale 2(S),3(S),4(R),5 -tetraidrossipentanale Data la difficoltà, si usano nomi specifici preceduti da D o L in base alla posizione del penultimo -OH (ultimo centro chirale). Il segno + (o -) indica la rotazione, oraria o antioraria, della luce polarizzata. la rappresentazione grafica, inoltre, deve basarsi su un sistema che specifichi chiaramente queste configurazioni isometriche. Viene utilizzato a tale scopo il sistema di Fisher. H 1 H O C C H 2 3 1 O OH C H2 OH D-gliceraldeide HO 2 H 3 C H2OH L-gliceraldeide D(+) glucosio ed L(-) glucosio sono enantiomeri ed epimeri O C H H C OH HO C H O C H HO C H H C OH H C OH HO C H H C OH HO C H CH2OH D(+) glucosio CH2OH L(-) glucosio CH2OH CH2OH CH2OH CH2OH C O C O C O C O H C OH HO C H H C OH HO C H HO C H HO C H H C OH H C OH H C OH H C OH H C OH H C OH CH2OH CH2OH CH2OH CH2OH D-psicosio D-fruttosio D-sorbosio D-tagatosio Legame emiacetlico Il gruppo pentagonale è detto furano. I monosaccaridi che lo contengono sono definiti furanosi CH2OH OH O CH2OH H H H H H OH -D-ribosio OH H O H H OH OH OH -D-ribosio .. 5 OH HOH2C 4 H H 3 HO 5 HOH2C 4 H OH O H 3 HO H 1 H 2 OH -D-ribofuranosio H C O H 1 D-ribosio 2 OH 5 4 H H O HOH2C H 3 HO H 1 OH OH 2 -D-ribofuranosio Il gruppo esagonale è detto pirano. I monosaccaridi che lo contengono sono definiti piranosi. I monosaccaridi più «famosi» Glucosio La forma (enantiomero) D-glucosio (da cui il nome anche di destrosio) è il monosaccaride più diffuso, presente in molti frutti: particolarmente nell’uva (per questo lo si conosce anche come zucchero d’uva). Nell’uomo lo si ritrova in tutte le cellule, particolarmente nel sangue (glicemia), nel fegato e nella milza. Dalla sua polimerizzazione si hanno: l’amido, la cellulosa, il glicogeno Forma anche i più diffusi disaccaridi: Il lattosio (con il galattosio) , il saccarosio (con il fruttosio) e il maltosio (due molecole di glucosio). L’utilizzo maggiore è quello di fornire energia agli esseri viventi con metabolismo glicolitico e respiratorio, ma ha anche compiti strutturali e funzionali. Può essere prodotto a partire dalla formaldeide. Questo fatto fa pensare che la sua presenza possa essere anche precedente all’origine della vita. Fruttosio La forma (enantiomero) D(-)-Fruttosio (data la polarizzazione levogira della luce è detto levulosio) è più dolce del glucosio ma ha un minore potere energetico. Lo si ritrova in molta frutta e, in particolare, nel nettare dei fiori (quindi anche nel miele) Forma il saccarosio (con il glucosio) L’utilizzo maggiore è quello di fornire energia agli esseri viventi con metabolismo glicolitico e respiratorio, ma ha anche compiti strutturali e funzionali. Artificialmente lo si ottiene per isomerizzazione del glucosio ricavato dall’amido del mais Galattosio È un epimero del glucosio Dopo il glucosio è il carboidrato più diffuso nel regno animale, ma lo si trova abbondante anche nei vegetali Con il glucosio forma il lattosio (disaccaride del latte) È il principale zucchero dei glicolipidi, forma anche le glicoproteine dei polmoni, lo si trova nel fibrinogeno, nelle gamma-globuline e nelle membrane cellulari. Viene trasformato in glucosio a livello del fegato per azione di due enzimi tra cui la galattosio-1-fosfato uridiltransferasi. La carenza di quest’enzima determina la galattosemia. Ribosio Desossiribosio Il nome, secondo alcuni testi, deriverebbe dal fatto che si estrae da alcune radici. Per la verità non ci sono fonti, animali o vegetali, da cui estrarli e commercializzarli in modo efficace. Nonostante quanto detto sopra, il ribosio, insieme al desossiribosio, è abbondante in tutte le cellule (nucleotidi) La cellula li ottiene per conversione enzimatica del glucosio. Commercialmente si producono sfruttando bioreattori selezionati (batteri) e da sciroppo di granoturco. L’utilizzo maggiore è quello di essere la base dei nucleotidi. Per riduzione (idrogenazione) di un aldoesoso si ottiene un polialcole O C H CH2OH H C OH H C OH HO C H NaBH4 HO C H H C OH H C OH H C OH H C OH CH2OH D-glucosio CH2OH sorbitolo Sorbitolo: è un dolcificante utilizzato anche come umettante (mantiene umido il genere alimentare). NaBH4 D-Xilitolo Lo xilitolo ha potere edulcorante pari a quello del saccarosio, ma potere calorico molto inferiore. Per questo, un tempo veniva consigliato ai diabetici. Viene generalmente impiegato nella formulazione di prodotti per l'igiene e la salute dei denti, grazie alla completa acariogenicità Per riduzione di un chetoesoso si ottengono due polialcoli epimeri CH2OH H C OH C O HO C H HO C H CH2OH CH2OH NaBH4 HO C H NaBH4 HO C H H C OH H C OH H C OH H C OH H C OH H C OH CH2OH CH2OH CH2OH mannitolo fruttosio sorbitolo Il mannitolo, ha scarso potere edulcorante, è utilizzato come antiedemigeno e come lassativo Chi più, chi meno, i polialcoli hanno un certo potere dolcificante e, in genere, non sono cariogeni e sono pertanto utilizzati in prodotti quali caramelle o chewing-gum ''senza zucchero''. Sono umettanti, per cui la loro aggiunta rende gli alimenti morbiti, meno secchi. Il metabolismo dei polialcoli è indipendente dall'insulina; sono quindi indicati nei diabetici. In seguito all'assunzione di queste sostanze, si può manifestare un effetto lassativo, riconducibile ad un effetto di tipo osmotico a livello intestinale. I DISACCARIDI Sono formati da due monosaccaridi, uniti con legame etere (tra 2 OHcon perdita di H2O) (legame O-glucosidico). I più importanti in biochimica umana sono: SACCAROSO = GLUCOSO + FRUTTOSO (è lo zucchero di canna) LATTOSO = GALATTOSO + GLUCOSO (è lo zucchero del latte) MALTOSO = GLUCOSO + GLUCOSO (è lo zucchero del malto) Enzimi idrolitici specifici (idrolasi) situati sull’epitelio intestinale idrolizzano il legame glucosidico e consentono l’assorbimento dei monosaccaridi. Il deficit di lattasi causa l’intolleranza al lattoso (diarrea da fermentazione batterica del lattoso non assorbito). DISACCARIDI La presenza del C1 (carbonilico) libero in maltoso e lattoso rende questi disaccaridi riducenti: possono essere evidenziati attraverso la riduzione di ioni metallici (Cu2+). H HOH2C HO O H HO H OH H MALTOSIO H HOH2C O HO O H H OH OH H In natura, il maltosio viene prodotto a partire dall’amido tramite l’azione dell’enzima amilasi ed è un componente del malto, sostanza ottenuta lasciando le granaglie ad ammorbidirsi e germinare nell’acqua. Il maltosio viene utilizzato nelle bevande, è idrolizzato dai lieviti nella produzione di birra e per l’organismo è una rapidissima fonte di energia (maldodestrine). Nell’uomo deve essere necessariamente idrolizzato da enzimi intestinali (maltasi). CH2OH Legame 1,4--glicosidico H CH2OH Galattosio O OH H OH H H OH H H OH O H OH Glucosio H OH O H E’ il principale carboidrato presente nel latte; è formato da galattosio e glucosio. Il lattosio non viene assorbito direttamente nel flusso ematico ma deve essere scisso in galattosio e glucosio dalla lattasi, emzima intestinale presente nei mammiferi in giovane età. lattosio Legame diglicosidico CH2OH O H H H OH H H OH O saccarosio OH CH2OH O OH H H H CH2OH H Zucchero da tavola, prodotto nel corso della fotosintesi; deve essere idrolizzato dalle saccarasi (enzima peculiare degli eucarioti) per essere utilizzato.
Scaricare