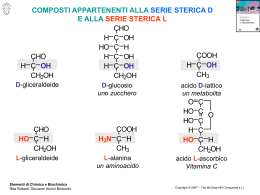
aa. 2013-14 CARBOIDRATI I carboidrati sono i composti organici più diffusi sulla terra; costituiscono più del 50% della massa secca di tutta la biomassa terrestre. Hanno un ruolo centrale nel metabolismo sia delle piante sia degli animali. Essi sono presenti nei cibi sia naturalmente che come ingredienti aggiunti e costituiscono la principale fonte energetica fornendo il 70-80% delle calorie in una dieta umana equilibrata. 1 Chitina Cellulosa Mureina Chitina Amido 2 CARBOIDRATI Il termine carboidrati va indietro nel tempo, quando si riteneva che tutti i composti di questa classe fossero idrati del carbonio sulla base della loro formula empirica del tipo Cx(H2O)y, tuttavia la composizione della maggior parte dei carboidrati naturali prodotti dagli organismi viventi non risponde a questa semplice formula empirica. Oggi sono classificati come carboidrati tutti i composti che hanno questa stessa reattività. 3 1 aa. 2013-14 CARBOIDRATI I carboidrati sono comunemente suddivisi in: Monosaccaridi carboidrati che non possono essere suddivisi in carboidrati di peso molecolare inferiore per idrolisi. Oligosaccaridi carboidrati costituiti generalmente da meno di 10 unità monosaccaridiche Polisaccaridi carboidrati costituiti da più di 10 unità monosaccaridiche 4 MONOSACCARIDI I monosaccaridi sono: poliidrossi-aldeidi (aldosi) considerati formalmente derivanti dalla gliceraldeide. CHO H OH CH2OH D-(+)-Gliceraldeide poliidrissi-chetoni (chetosi) considerati formalmente derivanti dal diidrossiacetone CH OH 2 C O CH2OH 5 Diidrossiacetone ALDOSI I composti della serie degli aldosi possono essere classificati in base al numero totale di carboni come: CHO triosi tetrosi CHO CHOH esosi CHOH CH2OH eptosi CHOH pentosi ottosi ... CH2OH CHO CHOH CHOH CHOH CH2OH 6 2 aa. 2013-14 CHETOSI I composti della serie dei chetosi possono essere classificati in base al numero totale di carboni come: triulosi CH 2OH tetrulosi pentulosi CH2OH CH C 2OH O C O CCHOH O CH2CHOH OH CHOH CH2OH esulosi CHOH eptulosi ottulosi C O ... CHOH CH2OH CH 2OH CH2OH 7 CHO CHO H C H OH OH CH2OH CH2OH R-(+)-Gliceraldeide D-(+)-Gliceraldeide R-(+)-Gliceraldeide 8 CHIRALITA CHO CHO HO C HO H H CH2OH CH2OH S-(−)-Gliceraldeide L-(−)-Gliceraldeide CH2OH C O CH2OH Diidrossiacetone 9 3 aa. 2013-14 Nomenclatura D-L negli zuccheri 1 CHO 1 CHO 2 HO 3 HO 2 H H 3 H H OH OH 4 CH2OH 4 CH2OH D-Eritrosio L-Eritrosio Il centro stereogenico a numero più alto ha la configurazione analoga a quella del L-gliceraldeide Il centro stereogenico a numero più alto ha la configurazione analoga a quella del D-gliceraldeide 10 Nomenclatura negli zuccheri carbonio anomerico CHO CHO H HO OH HO H H HO H H OH H H OH H OH OH CH2OH CH2OH D-(+)-Glucosio D-(+)-Mannosio 2 epimero del D-(+)-glucosio 11 CHO H OH CH2OH D-(+)-Gliceraldeide CHO CHO H OH HO H OH H CH2OH D-(−)-Eritrosio H OH CH2OH D-(−)-Treosio 12 4 aa. 2013-14 CHO H OH H OH CH2OH D-(−)-Eritrosio CHO CHO H OH HO H OH H H OH H CH2OH H OH OH CH2OH D-(−)-Ribosio D-(−)-Arabinosio CHO CHO CHO CHO H HO H H HO H OH HO H OH H OH HO H OH H OH H OH H H OH H OH H OH H CH2OH H OH H CH2OH D-(+)-Allosio OH OH CH2OH CH2OH D-(+)-Altrosio D-(+)-Glucosio 13 D-(+)-Mannosio CHO HO H H OH CH2OH D-(−)-Treosio CHO H HO H CHO OH HO H H HO H OH H CH2OH D-(+)-Xilosio D-(−)-Lixosio CHO CHO H OH HO H OH H HO H H HO OH H CH2OH CHO CHO H H OH HO H OH HO H HO H H HO H HO H OH H H OH CH2OH D-(−)-Gulosio OH CH2OH D-(−)-Idosio OH CH2OH CH2OH D-(+)-Galattosio 14 D-(+)-Tallosio CH2OH O CH2OH 1,3-Diidrossiacetone CH2OH O H OH CH2OH D-(−)-Eritrulosio CH2OH CH2OH O O H OH H H OH HO CH2OH CH2OH D-(+)-Xilulosio D-(+)-Ribulosio CH2OH CH2OH O H OH CH2OH O HO H H H OH H OH HO OH H OH H D-(+)-Psicosio CH2OH O H CH2OH OH H O OH HO H HO OH CH2OH CH2OH D-(−)-Fruttosio D-(+)-Sorbosio H H H OH CH2OH 15 D-(−)-Tagatosio 5 aa. 2013-14 Per i carboidrati la forma emiacetalica è termodinamicamente favorita rispetto alla forma a catena aperta aldeidica o chetonica 16 Anomero α o anomero β ? Nell'anomero α, l'atomo di ossigeno esociclico sul carbonio anomerico è formalmete cis, nella proiezione di Fischer, rispetto all'ossigeno legato all'atomo di riferimento per il centro anomerico (il carbonio chirale a più alto numero); Nell'anomero β tale ossigeno è formalmente trans. indica l'atomo di riferimento per l'assegnazione della configurazione α o β HO CH2OH OH OH OH CH2 OH OH OH OH O OH HO OH HO OH HO O OH O OH O CH2OH α-L-arabinopiranosio α-D-glucopiranosio CH2OH HO HO OH O OH HO OH O OH OH OH OH CH2OH CH2OH HO OH CH2OH O OH O OH CH2OH CH2OH 17 β-D-glucopiranosio β-D-fruttofuranosio Equilibrio di chiusura del glucosio (proiezioni di Haworth) CHO H HO OH H H OH H OH O CH2OH OH H H C O H OH CH2OH O H H H H HO CH2OH H CH2OH H OH H H OH HO C OH α -(D)-glucopiranosio 36% [α] = +112.0 O OH H H + OH H H OH HO C H β -(D)-glucopiranosio 64% [α] = +18.7 All'equilibrio [α] = +52.7 18 6 aa. 2013-14 IL FENOMENO DELLA MUTAROTAZIONE Basandosi sulla rotazione specifica della miscela, ed assumendo che la forma aperta non contribuisce alla rotazione, si ricavano le concentrazioni dei due anomeri 64% β e 36% α. 19 Catalisi acido-base della mutarotazione La trasformazione tra le due forme anomeriche avviene attraverso la forma aperta. Lapertura acido-catalizzata o base-catalizzata del ciclo è lo stadio determinante per la velocità di mutarotazione 20 Influenza del pH sulla velocità di mutarotazione 21 7 aa. 2013-14 Forme in equilibrio in soluzione acquosa per il fruttosio CH2OH CH2OH OH OH H O H CH2OH O CH2OH O CH2OH OH H OH H + OH H OH OH H CH2OH H CH2OH O HO OH H OH H H OH H OH H α -(D)-fruttofuranosio β -(D)-fruttofuranosio 4% H CH2OH H HO OH CH OH 2 H H OH O OH 20% H H O CH OH 2 H H OH + OH HO OH H α -(D)-fruttopiranosio H H O OH H H OH CH2OH HO OH H β -(D)-fruttopiranosio -% H 76% 22 Composizione % allequilibrio dei tautomeri del D-fruttosio 23 Altri zuccheri H HO H H CHO O NH C CH3 H OH OH CH2OH N-acertil-D-glucosammina H HO HO H CHO NH2 H H OH CH2OH D-galattosammina H HO H H CHO NH2 H OH OH CH2OH D-glucosammina H2 N HO H H CHO H H OH OH CH2OH D-mannosammina 24 8 aa. 2013-14 REAZIONI DEI MONOSACCARIDI Formazione degli acetali Formazione dei metil esteri Riduzione Ossidazione 25 Formazione degli acetali 26 27 9 aa. 2013-14 Formazione di acetali Meccanismo di reazione 28 Epimerizzazione In soluzione basica, lH sul C2 può essere rimosso per formare uno ione enolato. La riprotonazione può cambiare la stereochimica del carbonio C2. 29 Riarrangiamento attraverso la formazione di Enediolo In soluzione basica, la posizione del C=O può shiftare. Per preservare la struttura dello zucchero occorre operare in soluzione acida o neutra. 30 10 aa. 2013-14 Riduzione di zuccheri semplici Il gruppo carbonilico (C=O) di aldosi o chetosi può essere ridotto a gruppo alcolico (CHOH) con NaBH4 o H2/Ni. Il nome si costruisce aggiungendo la desinenza itolo alla radice del nome dello zucchero. La riduzione del D-glucosio produce il D-glucitolo, comunemente chiamato D-sorbitolo. La riduzione del D-fruttosio produce una miscela di D-glucitolo e D-mannitolo. 31 Formazione di alditoli O H OH H HO HO H H H O OH OH OH HO H H OH H OH H NaBH4 (o H2/Pt) OH HO H H OH H OH OH OH D-glucosio OH D-glucitolo 32 Esercizio: 1) Riducendo il D-ribosio con boroidruro di sodio si ottiene il D-ribitolo Si tratta di una molecola otticamente attiva? 2) Scrivere i prodotti di riduzione del D-fruttosio. 33 11 aa. 2013-14 Ossidazione con Bromo Lacqua di bromo ossida le aldeidi, ma non i chetoni o gli alcoli, ad acidi carbossilici. In realtà la reazione ha un decorso più complesso di quello che mostra la semplice equazione: 34 Ossidazione con acqua di bromo CH2OH O CH2OH HO Br2 OH HO OH H2O OH β -D-glucopiranosio O D-glucono-δ-lattone COOH CH2OH HO O HO HO OH O O HO OH OH OH OH CH2OH D-glucono- γ -lattone 35 acido D-gluconico Ossidazione con bromo CH2OH O Br HO HO CH2OH O O HO HO OH + HBr OH H intermedio per l'anomero β O D-glucono-δ-lattone CH2OH O HO H HO OH H H Br O intermedio per l'anomero α 36 12 aa. 2013-14 Ossidazione con acqua di bromo 37 Ossidazione con acido nitrico Lacido nitrico ossida sia la funzione aldeidica che quella alcolica terminale; il prodotto formato è un acido aldarico. 38 Ossidazione con acido nitrico O HO OH O OH H HO OH H H OH H OH H HNO3 60∞C HO OH H H OH H OH O O −H O 2 H H OH H OH D-Glucosio O OH Acido D-Glucarico (41%) O OH H O H H OH O OH O HO HO 39 13 aa. 2013-14 Acidi uronici Lossidazione del gruppo terminale CH2OH conservando la funzione carbonilica al C-1 (acido uronico acido aldeidocarbossilico) è possibile solo proteggendo il gruppo carbonilico durante lossidazione. 40 Acidi uronici 41 Reazione di ossidazione dei monosaccaridi Saggio di Benedict (Fehling) 42 14 aa. 2013-14 Saggio di Tollens O RCH O NH3/H2O + Ag(NH3)2+ − R C O + Ag0 Aldeidi OH RCCHR' O O NH3/H2O + Ag(NH3)2+ R C C R' + Ag0 O α-Idrossichetoni 43 Zuccheri non riducenti I glicosidi sono acetali, i quali sono stabili in soluzione basica, quindi non reagiscono con il reagente di Tollens (Felling o Benedict). 44 Sintesi di Kiliani-Fischer Questa reazione allunga la catena dellalcool. Si forma una miscela dei due epimeri. COOH CN H OH H OH 1) Ba(OH)2 2) H3O+ H H OH OH CH2OH CH2OH CHO H OH HCN cianidrine diastereomere (vengono separate) acidi aldonici diastereomeri CH2OH D-gliceraldeide COOH CN HO H H OH CH2OH 1) Ba(OH)2 2) H3O+ HO H H OH CH2OH 45 15 aa. 2013-14 Sintesi di Kiliani-Fischer COOH CHO O H OH H OH CH2OH acidi aldonici diastereomeri O OH Na-Hg, H2O H pH 3-5 H OH D-(−)-eritrosio γ - aldonolattoni diastereoisomeri CHO O H HO H O Na-Hg, H2O HO pH 3-5 H OH CH2OH OH CH2OH COOH HO OH OH H OH CH2OH D-(−)-treosio 46 Proporre un metodo per distinguere leritrosio dal treosio. 47 Disaccaridi I tipi di legame glicosidici di connessione che si riscontrano in natura sono: Legame 1-4 : il carbonio anomerico del primo zucchero è legato allossigeno del C4 del secondo zucchero. Legame 1-6 : il carbonio anomerico del primo zucchero è legato allossigeno del C6 del secondo zucchero. Legame 1-1 : I carboni anomerici dei due zuccheri sono legati attraverso un ossigeno. 48 16 aa. 2013-14 Saccarosio α-D-glucopiranosil-β-D-fruttofuranoside 49 Lattosio galattosio + glucosio legati 1-4’. OH HO emiacetalico riducente OH H O H H HO H O O H HO OH H H H H OH H OH legame β -galattosidico 4-O-β -D-galattopiranosil-D-glucopiranosio 50 Maltosio Due unità di glucosio unite con un legame 1,4 OH H HO HO H H H O H OH H OH O H HO H H O OH OH H legame α -1,4' glucosidico 4 -O-α -D-glucopiranosil-D-glucopiranosio 51 17 aa. 2013-14 Maltulosio Ununità di glucosio unita con una di fruttosio legame 1,4 HO OH H OH H HOHO O H H O HO H H OH H O OH H 4-O-α -D-glucopiranosil-D-fruttofuranosio 52 Cellobiosio Due unità di glucosio legate 1-4. Disaccaride della cellulosa. Zucchero riducente. OH H HO HO H H O OH H H OH H O HO H H H O H OH OH legame β -1,4' glucosidico 4-O-β -D-glucopiranosil-D-glucopiranosio 53 Gentiobiosio Due unità di glucosio legate 1-6. Raro come disaccaride, ma comunemente trovato come ramificazione nei polisaccaridi legame β -1,6' glucosidico OH H HO HO H H H O O OH H H CH2 HO HO H H H O OH OH H 6-O-β -D-glucopiranosil-D-glucopiranosio 54 18 aa. 2013-14 Polisaccaridi Conformazione di alcuni β-D-glucani a) Legame 1→4 b) Legame 1→3 c) Legame 1→2 55 pectina Polisaccaridi alginato 56 Polisaccaridi Stabilizzazione della conformazione ad elica a) Composti clatrati b) Doppia o triplice elica avvolta c) annidamento 57 19 aa. 2013-14 Amilosio • Frazione solubile dellamido, polimero del D-glucosio. • Forma un complesso con lo iodio di colorazione blu intensa. 58 Amilosio Il legame α-1,4-glicosidico nellamilosio è responsabile della sua forma ad elica levogira. Molti dei suoi gruppi OH formano legami idrogeno con lacqua 59 Amilopectina • Frazione insolubile dellamido α -1,6-glicosidico 60 20 aa. 2013-14 Glicogeno Polimero del glucosio simile allamilopectina, ma con un più alto livello di ramificazioni. Riserva energetica nei muscoli e nel fegato. Lalta ramificazione consente di immettere velocemente nel sangue il glucosio. 61 62 Cellulosa Polimero del D-glucosio, trovato nelle piante. I mammiferi non possiedono lenzima β-glicosidasi. 63 21 aa. 2013-14 Cellulosa I legami β -1,4-glicosidici nella cellulosa formano legami idrogeno intramolecolari che conferiscono al polimero un andamento lineare. 64 65 22
Scaricare