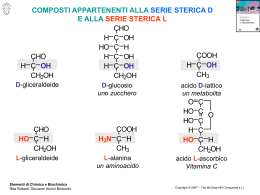
Prof. Giorgio Sartor Zuccheri e carboidrati Copyright © 2001-2008 by Giorgio Sartor. Versione 1.3 – oct 2008 All rights reserved. Carboidrati (CH2O)n HO H • Monosaccaridi – zuccheri semplici con più gruppi. In base al numero di atomi di carbonio (3, 4, 5, 6), un monosaccaride è un trioso, tetroso, pentoso o un esoso. • Disaccaridi - due unità monosaccaridiche legate covalentemente. • Oligosaccaridi - alcune unità monosaccaridiche legate covalentemente. • Polisaccaridi – polimeri che consistono in catene di unità monosaccaridiche o disaccaridiche. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati -2- 1 Monosaccaridi Aldosi (per es. glucoso) hanno un gruppo aldeidico ad un’estremità. H Chetosi (per es. fruttoso) hanno un gruppo chetonico generalmente in posizione C2. O CH2OH 2 O HO H H OH H OH 1 1 H HO H H 2 6 OH H OH OH CH2OH 6 D-Glucoso V.1.3 © gsartor 2001-2008 CH2OH D-Fruttoso Zuccheri e carboidrati -3- Isomeria ottica Gli zuccheri si definiscono D e L basandosi sulla configurazione dell’unico C asimmetrico nella gliceraldeide. CHO H OH HO CH2OH D-Gliceraldeide (proiezioni di Fisher) OH CH2OH Zuccheri e carboidrati H CH2OH L-Gliceraldeide CHO H V.1.3 © gsartor 2001-2008 CHO CHO HO H CH2OH -4- 2 Nomenclatura Per gli zuccheri con più di un centro chirale, D e L si riferiscono al C asimmetrico più distante dal gruppo aldeidico o chetonico. La maggior parte degli zuccheri naturali sono isomeri D. H O H HO H H OH H OH OH V.1.3 © gsartor 2001-2008 HO H HO HO CH2OH D-Glucoso O H H OH H H CH2OH L-Glucoso Zuccheri e carboidrati -5- Nomenclatura Gli zuccheri D ed L sono immagini speculari l’uno dell’altro. Hanno lo stesso nome (D-glucoso e L-glucoso). H H HO H H O OH H OH OH CH2OH D-Glucoso H HO H HO HO O H OH H H CH2OH L-Glucoso Gli altri stereoisomeri hanno nomi diversi (glucoso, mannoso, galattoso, ecc.). Il numero degli stereoisomeri è 2n, dove n è il numero dei centri di asimmetria. Gli aldoesosi hanno 4 centri asimmetrici. Ci sono quindi 24=16 stereoisomeri (8 D-aldoesosi e 8 L-aldoesosi). V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati -6- 3 Gliceraldeide CHO H CHO OH HO H CH2OH D-Gliceraldeide V.1.3 © gsartor 2001-2008 CH2OH L-Gliceraldeide Zuccheri e carboidrati -7- Due D-aldotetrosi H H V.1.3 © gsartor 2001-2008 CHO OH OH HO H CHO H OH CH2OH CH2OH D-Eritrosio D-Treosio Zuccheri e carboidrati -8- 4 Quattro D-aldopentosi H H H CHO OH OH OH HO H H CH2OH D-Riboso CHO H OH OH H HO H CH2OH HO HO H CH2OH D-Arabinoso V.1.3 © gsartor 2001-2008 CHO OH H OH D-Xiloso CHO H H OH CH2OH D-Lixoso Zuccheri e carboidrati -9- Quattro D-aldopentosi H H H CHO OH OH OH CH2OH D-Riboso V.1.3 © gsartor 2001-2008 HO H H CHO H OH OH H HO H CH2OH D-Arabinoso Zuccheri e carboidrati CHO OH H OH CH2OH D-Xiloso HO HO H CHO H H OH CH2OH D-Lixoso - 10 - 5 Otto D-aldoesosi CHO H H H H OH OH OH OH CHO HO H H OH H OH H OH CH2OH CH2OH D-Alloso H H HO H D-Altroso CHO OH HO OH H H HO OH H CHO H OH H OH CH2OH CH2OH D-Guloso D-Idoso V.1.3 © gsartor 2001-2008 H HO H H CHO OH H OH OH HO HO H H CH2OH D-Glucoso H HO HO H CHO OH H H OH CHO H H OH OH CH2OH D-Mannoso HO HO HO H CHO H H H OH CH2OH CH2OH D-Galattoso D-Taloso Zuccheri e carboidrati - 11 - Otto D-aldoesosi CHO H H H H OH OH OH OH HO H H H D-Alloso V.1.3 © gsartor 2001-2008 D-Altroso CHO OH HO OH H H HO OH H CHO H OH H OH CH2OH CH2OH D-Guloso H HO H H CH2OH CH2OH H H HO H CHO H OH OH OH D-Idoso CHO OH H OH OH HO HO H H CH2OH D-Glucoso H HO HO H CHO OH H H OH CHO H H OH OH CH2OH D-Mannoso HO HO HO H CHO H H H OH CH2OH CH2OH D-Galattoso D-Taloso Zuccheri e carboidrati - 12 - 6 Chetozuccheri CH2OH O Vi è un solo chetotrioso: CH2OH Diidrossiacetone Vi sono quindi 2 chetotetrosi stereoisomeri CH2OH CH2OH O H OH O HO CH2OH CH2OH L-Eritrulosio D-Eritrulosio V.1.3 © gsartor 2001-2008 H Zuccheri e carboidrati - 13 - Due D-chetopentosi H H CH2OH O OH HO OH H CH2OH O H OH CH2OH CH2OH D-Ribuloso V.1.3 © gsartor 2001-2008 D-Xiluloso Zuccheri e carboidrati - 14 - 7 Due D-chetopentosi H H CH2OH O OH HO OH H CH2OH O H OH CH2OH CH2OH D-Ribuloso V.1.3 © gsartor 2001-2008 D-Xiluloso Zuccheri e carboidrati - 15 - Quattro D-chetoesosi H H H CH2OH O OH OH OH CH2OH D-Psicoso V.1.3 © gsartor 2001-2008 HO H H CH2OH O H OH OH H HO H CH2OH D-Fruttoso CH2OH O OH H OH CH2OH D-Sorboso Zuccheri e carboidrati HO HO H CH2OH O H H OH CH2OH D-Tagatoso - 16 - 8 Quattro D-chetoesosi H H H CH2OH O OH OH OH CH2OH D-Psicoso HO H H CH2OH O H OH OH CH2OH O OH H OH H HO H CH2OH D-Fruttoso V.1.3 © gsartor 2001-2008 CH2OH D-Sorboso HO HO H CH2OH O H H OH CH2OH D-Tagatoso Zuccheri e carboidrati - 17 - Formazione di semiacetali e semichetali R Un’aldeide può reagire con un alcol per formare un semiacetale. Un chetone può reagire con un alcol per formare un semichetale. .. R' O H R + H δ+ δ− O H O O H R' R' H O H R sp2 sp3 R .. R'' O H R + R' δ+ δ− O R' O O H R'' R'' R V.1.3 © gsartor 2001-2008 O Zuccheri e carboidrati O R' O H - 18 - 9 Pentosi ed esosi possono ciclizzare attraverso la reazione tra un OH distale e il gruppo chetonico. 6 CH 6 H HO O 1 H HO H H O 5 HO 2 OH 3 H OH 4 O 5 H CH2OH OH 1 2 OH O 6 HO O H OH OH OH HO 2OH 5 4 3 4 H H H OH OH H OH CH2OH O H OH H OH α-D-Glucopiranoso 1 OH 2 3 OH H H OH β-D-Glucopiranoso H OH Il glucoso forma un semiacetale intramolecolare tra il C1 aldeidico e l’OH in C5 per formare un ciclo a sei termini (struttura piranosica, dal pirano). V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 19 - Pentosi ed esosi possono ciclizzare attraverso la reazione tra un OH distale e il gruppo chetonico. HO 5 H O HO 1 H HO H H 2 3 4 5 CH2OH O H HO OH H O H OH 6 CH2OH 5 CHOH 6 OH 1 4 2 3 H O 4 OH OH 1 H α-D-Glucofuranoso OH H 3 H 2 OH CH2OH HO CHOH 6 HO O H HO OH H O OH OH H H OH H OH β-D-Glucofuranoso Il glucoso forma un semiacetale intramolecolare tra il C1 aldeidico e l’OH in C54 per formare un ciclo a cinque termini (struttura furanosica, dal furano). V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 20 - 10 1 CH2OH 2 O HO 3 H H 4 OH H 5 O H CH2OH 6 6 CH2OHO 5 H H 1 CH2OH OH 3 4 OH 2 OH H α-D-fruttofuranoso • Il fruttoso forma sia semichetali ciclici - a 6-membri (anello piranosico) per reazione tra il gruppo chetonico in C2 e l’OH in C6, o - a 5-membri (anello furanosico) per reazione tra il gruppo chetonico in C2 e l’OH in C5. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 21 - La ciclizzazione del glucosio produce un nuovo centro di asimmetria al C1. I due stereoisomeri sono chiamati anomeri α e β. 6 CH H O 1 H HO H H 2 3 4 5 OH H OH OH CH2OH H 4 OH 2 OH 5 O H OH 3 H 6 OH H 1 OH α-D-Glucoso 2 H OH CH2OH O H OH H H H OH β-D-Glucoso H OH Nella proiezione di Haworth il gruppo OH legato al C1 anomerico è al di sotto del piano dell’anello nell’anomero α mentre è al di sopra nell’anomero β. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 22 - 11 A causa degli angoli di legame del carbonio sp3 la configurazione che uno zucchero in forma ciclica assume può essere a sedia o barca (come i cicloalcani). H H 6 H HO 6 1 O OH H OH H 5 1 5 4 H 3 OH α-D-Glucoso 4 3 2 H 2 OH H OH H HO O H H OH H β-D-Glucoso H H OH OH V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 23 - A causa degli angoli di legame del carbonio sp3 la configurazione che uno zucchero in forma ciclica assume può essere a sedia o barca (come i cicloalcani). H H 6 H HO 1 O H OH H 6 5 1 5 4 H 3 OH 2 OH α-D-Glucoso 4 3 2 H OH H OH H HO O H H OH H β-D-Glucoso H H OH V.1.3 © gsartor 2001-2008 OH Zuccheri e carboidrati - 24 - 12 Derivati degli zuccheri • Alcoli H H H – Assenza del gruppo aldeidico o chetonico (riduzione) CH2OH OH OH OH CH2OH D-Ribitolo • Acidi – Per ossidazione del gruppo aldeidico o del gruppo alcolico I H HO H H COOH OH H OH OH H HO H H CH2OH COOH Acido D-Gluconico V.1.3 © gsartor 2001-2008 CHO OH H OH OH Acido D-Glucuronico Zuccheri e carboidrati - 25 - Derivati degli zuccheri CH2OH CH2OH • Aminozuccheri H OH H O H H OH H H NH2 OH H H OH O α-D-N-acetilglucosamina O H N H3 C Zuccheri e carboidrati HN CH3 H H H V.1.3 © gsartor 2001-2008 H OH α-D-glucosamina • Acido N-acetilneuraminico (Acido Sialico) O H OH H O OH OH H OH CH2OH H COOH OH H - 26 - 13 Derivati degli zuccheri • Aminozuccheri α-D-N-acetilglucosamina • Acido N-acetilneuraminico (Acido Sialico) V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 27 - Legame glicosidico • Il gruppo OH anomerico può formare un legame etereo con un altro alcol: R O H + R O R' O H R' H O + H H 3C O H O O CH3 H OH H H H OH H H HO OH H OH H H H H H HO H O + H OH OH OH • In questo caso si forma il metilglucoside • Il legame glicosidico impedisce la formazione dell’equilibrio fra gli anomeri. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 28 - 14 Disaccaridi • Maltosio – Prodotto di degradazione dell’amido, è un disaccaride formato da due unità di glucosio legate da un legame α(1→ 4) glicosidico tra l’OH in C1 di una molecola di glucosio e l’OH in C4 di un’altra. CH2OH H OH CH2OH O H OH H H 4 1 H O H OH H H OH O H V.1.3 © gsartor 2001-2008 OH H OH Zuccheri e carboidrati - 29 - Disaccaridi • Maltosio – Prodotto di degradazione dell’amido, è un disaccaride formato da due unità di glucosio legate da un legame α(1→ 4) glicosidico tra l’OH in C1 di una molecola di glucosio e l’OH in C4 di un’altra. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 30 - 15 Disaccaridi • Cellobiosio – Prodotto di degradazione della cellulosa, è un disaccaride formato da due unità di glucosio legate da un legame β(1→ 4) glicosidico tra l’OH in C1 di una molecola di glucosio e l’OH in C4 di un’altra. CH2OH H OH CH2OH O H OH H H OH V.1.3 © gsartor 2001-2008 O H O 1 4 H H OH H H OH H OH Zuccheri e carboidrati - 31 - Disaccaridi • Cellobiosio – Prodotto di degradazione della cellulosa, è un disaccaride formato da due unità di glucosio legate da un legame β(1→ 4) glicosidico tra l’OH in C1 di una molecola di glucosio e l’OH in C4 di un’altra. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 32 - 16 Disaccaridi • Saccarosio – Lo zucchero di canna, è un eterodisaccaride formato da una unità di glucosio ed una di fruttosio connessi da un legame diglicosidico α(1→ 2)β CH2OH CH2OH O H H H OH H H OH OH O H H OH H H OH OH O H H OH OH H HOH2C O O H CH2OH CH2OHO H H OH OH H CH2OH V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 33 - Disaccaridi • Saccarosio – Lo zucchero di canna, è un eterodisaccaride formato da una unità di glucosio ed una di fruttosio connessi da un legame diglicosidico α(1→ 2)β CH2OH O H H H OH H H OH OH O CH2OHO H V.1.3 © gsartor 2001-2008 H OH OH H CH2OH Zuccheri e carboidrati - 34 - 17 Disaccaridi • Lattosio – Zucchero del latte, è un disaccaride formato da una unità di glucosio e una di galattosio legate da un legame α(1→ 4) glicosidico tra l’OH in C1 della molecola di galattosio e l’OH in C4 del glucosio CH2OH OH H CH2OH O H OH H H 4 1 H O H OH H H OH O H V.1.3 © gsartor 2001-2008 OH H OH Zuccheri e carboidrati - 35 - Disaccaridi • Lattosio – Zucchero del latte, è un disaccaride formato da una unità di glucosio e una di galattosio legate da un legame α(1→ 4) glicosidico tra l’OH in C1 della molecola di galattosio e l’OH in C4 del glucosio V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 36 - 18 Polisaccaridi • Negli organismi i polisaccaridi hanno varie funzioni: – Di deposito dei monosaccaridi: • Amilosio e amilopectina (amido), Glicogeno – Strutturale • Cellulosa, Mucopolisaccaridi – Di adesione e riconoscimento • Eparansolfato, eparina • Proteoglicani e glicoproteine V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 37 - Polisaccaridi di deposito H OH CH2OH O H OH H H OH H 4 H 1 CH2OH O H OH H H OH O H 4 H 1 O CH2 OH O H OH H H OH H 4 H 1 CH2OH O H OH H H OH H 1 H 4 O O CH2OH O H OH H H OH H 4 H 1 CH2 OH O H OH H H OH O H OH • Le piante conservano il glucosio come amilosio o amilopecina, questi sono polimeri del glucosio comunemente chiamati amido. La forma polimerica del glucosio minimizza l’effetto osmotico. - L’Amilosio è un polimero con legami α(1→4) che assume una conformazione ad elica. - Il polisaccaride termina con un C1 anomerico che non è coinvolto nel legame glicosidico ed è riducente. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 38 - 19 Polisaccaridi di deposito - L’Amilopectina è un polimero del glucosio tenuto insieme principalmente da legami α(1→4) che però ha ramificazioni con legami α(1→6). - Le ramificazioni producono una struttura più compatta che non l’amilosio. - La presenza di più terminali di catena facilita l’attacco enzimatico per la degradazione. CH2OH O H H OH OH OH H OH CH2OH O H OH H OH H 1 H 4 H 1 OH H O OH 6 CH2 CH2OH O H OH H O H 4 H 1 O O H H H O H H 1 H CH2OH O H 4 H H OH H H OH H 4 H 1 CH2 OH O H OH H H OH H 1 H 4 O O OH V.1.3 © gsartor 2001-2008 CH2OH O H OH H H OH CH2 OH O H 4 H 1 H OH H H OH H OH O Zuccheri e carboidrati - 39 - Polisaccaridi di deposito - Il glicogeno è simile all’amilopectina è tenuto insieme principalmente da legami α(1→4) con maggiori ramificazioni α(1→6). - Questa struttura permette una rapida mobilizzazione del glucosio conservato in deposito come glicogeno. H OH H OH CH2OH O H OH H H CH2OH O H OH H H OH H H 1 O 4 OH V.1.3 © gsartor 2001-2008 H 1 H 4 O CH2OH O H OH H H OH CH2OH O H OH H H OH H 1 O 6 CH2 H H 1 4 O O H OH H H OH H 1 O H 4 CH2 OH O H OH H H 1 O H Zuccheri e carboidrati OH H 4 CH2OH O H OH H H OH H H1 O n CH2OH O H 4 OH H H H OH OH - 40 - 20 Polisaccaridi strutturali CH2OH H OH CH2OH O H OH H H OH O H CH2OH O H H OH H H OH H O H CH2OH O H OH H H OH O H CH2OH O H H OH H H OH H H O CH2OH O H OH H H OH O H O H n H OH H H OH H OH • La cellulosa è il maggior costituente della parete cellulare delle piante e consiste in lunghe catene di glucoso legato con legami β(1→4). V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 41 - Polisaccaridi strutturali • Cellulosa: ogni residuo di glucoso è ruotato di 180° rispetto al precedente, ciò porta alla formazioni di legami idrogeno tra catene affiancate per formare fibre. V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 42 - 21 Polisaccaridi strutturali • Glicosaminoglicani. (mucopolisaccaridi) sono polimeri di unità disaccaridiche modificate con gruppi acidi, aminici, solfati. • I Glicosaminoglicani tendono ad essere carichi negativamente per la prevalenza di gruppi acidi. N-Acetil-D-Glucosamina Acido D-Glucuronico COOH H * O CH2OH O H H H OH O O H OH H H OH H O * H NHCOCH3 n H Acido Ialuronico • L’acido Ialuronico consiste in un disaccaride formato da Acido D-glucuronico legato a una molecola di N-Acetil-DGlucosamina legati tra loro con legami β(1→3) e β(1→4). V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 43 - Polisaccaridi di adesione e riconoscimento • L’eparansolfato è sintetizzato in una proteina di membrana come polimero che alterna residui di Nacetilglucosamina e glucuronato. • Il seguito, in segmenti del polimero, I residui di glucuronato possono essere convertiti in zuccheri solfatati (acido iduronico) mentre i residui di N-acetilglucosamina possono essere deacetilati e/o solfatati. Acido Iduronico-2-solfato N-Acetil-D-Glucosamina H H * O O COOH OH H H H O H OSO3H CH2OSO3H O O H OH H H H * NHR n Eparina R= -SO3H Eparansolfato R= -COCH3 V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 44 - 22 Polisaccaridi di adesione e riconoscimento • Questi polisaccaridi sono legati covalentemente al proteine inserite nella membrana plasmatica. • Le proteine coinvolte nel riconoscimento e l’adesione riconoscono e legano particolari patterns di solfatazione degli zuccheri. proteina eparansolfato glicosaminoglicano α-elica transmembrana citosol V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 45 - Glicoproteine • Le glicoproteine hanno funzioni di riconoscimento e comunicazione tra cellule. • Sono formate dal legame di un aminoacido, in genere idrossilato (serina o treonina) per formare una glicoprotena Olinked, o aminico (lisina, asparagina, glutamina o arginina) per formare una glicoproteina N-linked, con una catena oligosaccaridica (lineare o ramificata) di diversa complessità. N-Acetil-D-Glucosamina H OH CH2OH O H OH H H V.1.3 © gsartor 2001-2008 O H H O * O Residuo di Serina HN NHCOCH3 Zuccheri e carboidrati * - 46 - 23 Glicoproteine • Il diverso pattern dei residui di zuccheri fondamentale nei meccanismi di riconoscimento. è NAN NAN • NAG N-acetilglucosamina • Fuc Fucoso • Man Mannoso • Gal Galattoso Gal Gal NAN NAG Gal NAG NAG Man Man Man • NAN Acido Nacetilneuraminico NAG NAG Fuc Asn V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 47 - Derivati degli aminozuccheri CH2OH H OH O O H OH H H HN H H3 C H OH H H O CH3 α-D-N-acetilglucosamina V.1.3 © gsartor 2001-2008 H N Zuccheri e carboidrati H O OH OH H OH CH2OH H COOH OH H Acido sialico - 48 - 24 V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 49 - V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 50 - 25 V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 51 - V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 52 - 26 Apolipoproteina-H umana (1C1Z) Asn NAG Man V.1.3 © gsartor 2001-2008 Zuccheri e carboidrati - 53 - Crediti e autorizzazioni all’utilizzo • Questo materiale è stato assemblato da informazioni raccolte dai seguenti testi di Biochimica: – CHAMPE Pamela , HARVEY Richard , FERRIER Denise R. LE BASI DELLA BIOCHIMICA [ISBN 9788808-17030-9] – Zanichelli – NELSON David L. , COX Michael M. I PRINCIPI DI BIOCHIMICA DI LEHNINGER - Zanichelli – GARRETT Reginald H., GRISHAM Charles M. BIOCHIMICA con aspetti molecolari della Biologia cellulare - Zanichelli – VOET Donald , VOET Judith G , PRATT Charlotte W FONDAMENTI DI BIOCHIMICA [ISBN 9788808-06879-8] - Zanichelli • E dalla – – – – consultazione di svariate risorse in rete, tra le quali: Kegg: Kyoto Encyclopedia of Genes and Genomes http://www.genome.ad.jp/kegg/ Brenda: http://www.brenda.uni-koeln.de/ Protein Data Bank: http://www.rcsb.org/pdb/ Rensselaer Polytechnic Institute: http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/MB1index.html • Il materiale è stato inoltre rivisto e corretto dalla Prof. Giancarla Orlandini dell’Università di Parma alla quale va il mio sentito ringraziamento. Questo ed altro materiale può essere reperito a partire da: http://www.ambra.unibo.it/giorgio.sartor/ oppure da http://www. gsartor.org/ Il materiale di questa presentazione è di libero uso per didattica e ricerca e può essere usato senza limitazione, purché venga riconosciuto l’autore usando questa frase: Materiale ottenuto dal Prof. Giorgio Sartor Università di Bologna a Ravenna Giorgio Sartor - [email protected] 27
Scaricare