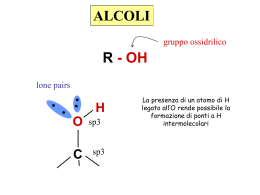
Alcoli •Sono composti in cui un idrogeno di un alcano è sostituito da un gruppo OH •OH gruppo funzionale •L’ossigeno ha la stessa geometria dell’ossigeno dell’acqua •Suffisso olo Gli alcoli sono composti che contengono un ossidrile, –OH, legato ad un carbonio ibridato sp3 Alcuni alcoli hanno più di un ossidrile, come ad esempio 1’1,2-etandiolo, noto anche come glicol etilenico, usato come liquido anticongelante nei radiatori delle automobili. Altri alcoli hanno molecole grandi e complesse delle quali il gruppo ossidrile costituisce una parte piccola, ma importante: il colesterolo, principale costituente dei calcoli biliari e ben noto fattore di rischio nelle malattie cardiovascolari, ne è un tipico esempio Nomi d’uso degli alcoli Il nome d’uso consiste nella parola alcol seguita dal nome del radicale alchilico. La nomenclatura IUPAC prevede l’uso del suffisso olo. Ad esempio il nome IUPAC dell’alcol etilico è etanolo Regole IUPAC: •trovo la catena di atomi di carbonio più lunga contenente il gruppo OH; •sostituisco con il suffisso “-olo” la desinenza “-o” del nome sistematico della porzione; •numero la catena carboniosa in modo da dare al gruppo funzionale OH il numero più basso; •attribuisco a tutti i sostituenti la propria posizione. IUPAC classica Legami idrogeno tra molecole di alcoli. Poiché l’ossigeno è molto più elettronegativo del C e dell’H, i legami CO e O-H sono polari. La polarità del legame O-H porta alla formazione di legami idrogeno tra le molecole di alcol, il che ha come conseguenza l’alto punto di ebollizione tipico degli alcoli. La solubilità in acqua dei termini a basso peso molecolare e di quelli più complessi che presentano vari ossidrili (dioli, trioli, … polioli), è riconducibile anch’essa alla formazione di legami idrogeno. Queste proprietà rendono gli alcoli buoni solventi per svariate reazioni. Eteri Gli eteri sono composti organici in cui un ossigeno è legato a due gruppi alchilici. Se i due sostituenti sono uguali, l’etere si definisce simmetrico. Se i due sostituenti sono diversi, l’etere è asimmetrico Il nome d’uso degli eteri si costruisce utilizzando il nome dei due sostituenti alchilici, in ordine alfabetico, seguiti dalla parola “etere” Nomenclatura Si usano due modi per denominarli. Per gli eteri semplici, il nome deriva direttamente da quelli dei due gruppi alchilici legati all’atomo di ossigeno ai quali si aggiunge la parola etere. Per molecole più complesse, il gruppo alchilico (o arilico) più semplice e l’ossigeno al quale esso è legato sono denominati come gruppo alcossilico (o arilossilico) e considerati come un sostituente della catena più complessa. Preparazione degli alcoli Addizione di acqua L’addizione di acqua al doppio legame di un alchene fornisce un alcol: ad esempio, il propene viene trasformato dagli acidi diluiti in alcol isopropilico. È un’addizione secondo Markovnikov e la reazione inizia con l’interazione tra l’elettrofilo, che è lo ione idronio, e il doppio legame. Reazione di eliminazione Un alcol può subire una reazione di eliminazione perdendo acqua per formare il corrispondente alchene (reazione di disidratazione). •La reazione avviene in ambiente acido •La reazione segue la regola di Zaitsev •La reazione procede con un meccanismo E1 per alcoli secondari e terziari. •La reazione avviene piuttosto difficilmente per gli alcoli primari. Meccanismo della disidratazione acido-catalizzata •Protonazione dell’ossigeno alcolico •Formazione del carbocatione •β eliminazione ad opera dell’acqua Reattività degli alcoli nella reazione E1 Poiché la reazione procede con meccanismo E1 dove lo stadio lento è la formazione del carbocatione, la velocità di disidratazione riflette la facilità con cui può formarsi il carbocatione. Gli alcoli terziari sono i più reattivi. Rimozione di acqua in biomolecole ossidrilate mediante catalisi enzimatica Dissociazione acida degli alcoli Alcoli vs Tioli: Acidità e basicità I tioli (corrispondenti degli alcoli, in cui l’O è sostituito con lo S) sono acidi più forti dei corrispondenti alcoli; tanto forti che, sciolti in soluzione acquosa di idrossido di Na si trasformano completamente nei corrispondenti sali di Na. Al contempo, sono basi più deboli. Lo S si trova sotto l’O nella tavola periodica ed è un atomo più grande, quindi la carica negativa sullo S è meno concentrata in ogni singolo punto dello spazio, di quella localizzata sull’O. L’anione dello S è perciò più stabile, rispetto al proprio acido coniugato, di quanto non lo sia l’anione dell’O. Un anione più stabile corrisponde, a una base più debole, a una base che ha minor propensione ad essere protonata per formare il suo acido coniugato. In generale, quindi, muovendosi all’interno di un gruppo della tavola periodica, l’acidità di un acido protico cresce con le dimensioni dell’atomo a cui è legato il protone. OSSIDO-RIDUZIONI IN CHIMICA ORGANICA -1 +3 +1 0 +2 -2 -2 R-CH2-CH2-R -1 -1 2H R-CH=CH-R H2O 0 -2 R-CHOH-CH2-R +2 -2 2H R-CO-CH2-R Beta-ossidazione degli acidi grassi O acetilCoA S C H3C CoA CoA H2 O COOH C O COOH CH2 1 CH2 HO ossaloacetato COOH citrato - NADH+H + 8 COOH H C NAD+ COOH CH2 COOH 2 1 8 2 2°deidrogenazione COOH malato 7 C isomerizzazione C HOOC C H isocitrato CH2 COOH 3 1°decarbossilazione ossidativa CH FADH 2°decarbossilazione ossidativa C fosforilazione a livello del substrato FAD NAD NADH+H COOH CH2 GTP GDP+Pi CH2 COOH succinato 5 + C S CoA CH2 CH2 chetoglutarato CoA SH CH2 COOH succinil-CoA + O COOH 4 O CH2 CoA SH CO2 + COOH 5 2 3 4 1°deidrogenazione COOH NAD + NADH+H 6 CH 6 OH 7 idratazione COOH fumarato COOH H condensazione OH CH2 H2 O SH CO2 DISOLFURO Ossidazione del Glutatione (GSH)
Scaricare