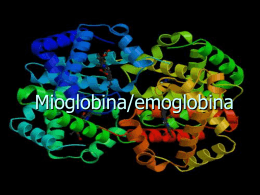
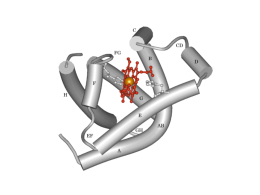
EMOGLOBINA Hemoglobin Hb HbO2 Hb(O2)4 [Mioglobina (Mb)] α2β2 Emoglobina/mioglobina: il gruppo eme non è legato in modo covalente Emoglobina ossigenata (FeII-O2) Ossiemoglobina (+ 4O2) Deossiemoglobina (senza O2) Emoglobina ossidata (FeIII), - metaemoglobina (“meta”) - non lega ossigeno Monossido di carbonio, CO - affinità 200 volte più dell’O2 - legame è reversibile Legame dell’ossigeni alla mioglobina Mb + O2 ⇆ MbO2 Legame dell’ossigeni alla mioglobina Hb + O2 ⇆ HbO2 HbO2 + O2 ⇆ Hb(O2)2 Hb(O2)2 + O2 ⇆ Hb(O2)3 Hb(O2)3 + O2 ⇆ Hb(O2)4 NB: K1 < K2 < K3 < K4 (K4 ~ 100×K1) Grafico di Hill (coefficiente di Hill) Forma T Forma R (tesa) (rilassata) L’ossigeno che si lega al ferro causa un cambiamento nella struttura della proteina (interazioni tra subunità) Proteina allosterica (cooperatività) Modelli per spiegare l’effetto allosterico (cooperativo) L’effetto Bohr: pH bassa → bassa affinità → rilascio di O2 -His-H+ Terminal-NH3+ Ruolo dell’emoglobina nel trasporto di CO2 dai tessuti ai polmoni Trasporto diretto della CO2 dall’emoglobina: carbammato Hb-NH2 + CO2 Hb-NH-COO- + H+ BPG si lega soltanto alla deossiemoglobina: abassa l’affinità per l’ossigeno Risultato totale di - l’effetto Bohr - CO2 - BPG
Scaricare