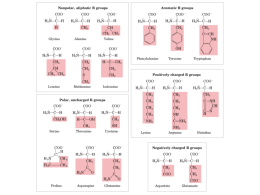
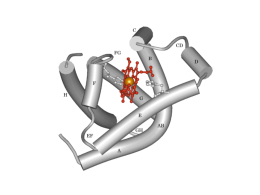
EMOGLOBINA : TRASPORTO DELL’OSSIGENO. La transizione dalla vita anaerobica alla vita aerobica rese disponibile una grande riserva di energia. In presenza di O2 è possibile estrarre dal glucoso una quantità di energia 18 volte maggiore, ed è possibile usare come fonte di energia anche lipidi e protidi. I vertebrati hanno selezionato dei meccanismi per rifornire in modo adeguato tutte le cellule di O2 : -- Un sistema circolatorio, indispensabile per organismi di dimensioni maggiori di un mm3. -- Molecole trasportatrici di ossigeno che permettono di aumentare la solubilità nell’acqua del gas (1 l di H2O solubilizza 5 ml di O2 , 1 l di sangue 250 ml) e di ridurre la produzione dei radicali liberi dell’ossigeno,molto dannosi per tutte le molecole biologiche. CROMOPROTEINE - Emoglobina - mioglobina - citocromi - enzimi eminici MIOGLOBINA ED EMOGLOBINA SONO PROTEINE CONIUGATE COSTITUITE DA UNA PARTE PROTEICA (GLOBINA) E DA UN GRUPPO PROSTETICO (FERROPROTOEME) CHE E’ ALLOGGIATO IN UNA TASCA DELLA GLOBINA E CHE LEGA REVERSIBILMENTE L’OSSIGENO LA MIOGLOBINA E’ UNA PROTEINA MONOMERICA COSTITUITA DA UNA SINGOLA CATENA POLIPEPTIDICA LEGATA AD UN SINGOLO GRUPPO EME L’EMOGLOBINA E’ UNA PROTEINA TETRAMERICA COSTITUITA DA QUATTRO CATENE POLIPEPTIDICHE CIASCUNA LEGATA AD UN GRUPPO EME LA MIOGLOBINA E’ COSTITUITA DA UNA CATENA DI 153 AMMINOACIDI (STRUTTURA PRIMARIA) CHE SI SVILUPPA NELLO SPAZIO FORMANDO OTTO ELICHE (STRUTTURA SUPERSECONDARIA) ORGANIZZATE IN UN UNICO DOMINIO (STRUTTURA TERZIARIA) L’EMOGLOBINA HA UNA STRUTTURA QUATERNARIA. CONTIENE 4 CATENE GLOBINICHE: 2 (CON 141 AMMINOACIDICI) RIPIEGATE IN 7 REGIONI AD ELICA) E 2 (CON 146 AMMINOACIDI) RIPIEGATE IN 8 REGIONI AD -ELICA). A CIASCUNA CATENA GLOBINICA E’ LEGATO UN FERROPROTOEME IL GRUPPO EME ORIGINA DALLA PORFINA IL FERROPROTOEME DERIVA DALLA PROTOPORFIRINA IX L’OSSIGENO SI LEGA REVERSIBILMENTE AL FERRO DELL’EME Il Fe (allo stato ferroso) forma sei legami di coordinazione: 4 con gli N dell’anello porfirinico Il 5° con l’His F8 Il 6° con l’O2 COMPLESSO DELL’EME NELLA MIOGLOBINA STRUTTURA DELLA MIOGLOBINA Le strutture della mioglobina, delle catene e di tutte le catene delle Hb di tutti i vertebrati sono molto simili nella struttura terziaria, anche se le strutture primarie sono differenti: LA CONFORMAZIONE E’ RESPONSABILE DELLA FUNZIONE RUOLO DELLA GLOBINA Crea un ambiente idrofobico che impedisce l’ossidazione del Fe++ a Fe+++; His E7 (distale) diminuisce l’affinità del CO da 25.000 volte maggiore dell’O2 a solo 210 volte Deossi Hb L’Hb è un tetramero Ossi Hb Durante la vita si susseguono diverse emoglobine Emoglobine embrionali Hb Emoglobina fetale HbF Emoglobine dell’adulto HbA HbA2dell’emoglobina totale) L’Hb è un tetramero in cui ogni subunità ha una struttura tutta ad -elica. I contatti tra le subunità - sono di due tipi: -- Le associazioni e sono contatti estesi ed importanti per l’impacchettamento delle subunità (non si modificano quando l’Hb lega l’O2). -- Le regioni di contatto e sono chiamate regioni di scorrimento Ponti salini tra subunità differenti della Hb. Sono interazioni elettrostatiche, non covalenti, che vengono rotte in seguito all’ossigenazione. Curve di saturazione della Mb e della Hb p50 Hb = 26 torr p50 Mb = 2,8 torr pO2 = pressione parziale di O2 YO2 = saturazione frazionale EFFETTO COOPERATIVO Il legame dell’effettore alle subunità non avviene in maniera indipendente perché l’affinità dei singoli protomeri verso lo stesso effettore può essere diversa (aumentata o diminuita) in relazione allo stato della conformazione quaternaria dell’enzima. L’effetto cooperativo deriva dalle interazioni tra protomeri. EFFETTO COOPERATIVO POSITIVO L’affinità dell’oligomero verso l’effettore aumenta quando una o più subunità dell’oligomero stesso hanno già legato l’effettore. EFFETTO COOPERATIVO NEGATIVO L’affinità dell’oligomero verso l’effettore diminuisce quando una o più subunità dell’oligomero stesso hanno già legato l’effettore. La maggior parte degli enzimi allosterici sono regolati dallo stesso substrato con effetto omotropico positivo, cooperativo positivo. Modifiche conformazionali dell’Hb conseguenti all’ossigenazione Blu forma T deossiHb Rossa forma R ossiHb Movimenti dell’interfaccia durante la transizione T R MODELLO SIMMETRICO DI MONOD MODELLO SEQUENZIALE DI KOSHLAND EFFETTORI ALLOSTERICI NEGATIVI -pH -CO2 -2,3 bisfosfoglicerato EFFETTO BOHR L’affinità dell’Hb per l’O2 aumenta all’aumentare del pH. TRASPORTO CO2 Ruolo dell’Hb nel trasporto della CO2 Effetto del BPG e della CO2 sulla curva di dissociazione dell’Hb Il BPG è presente nel sangue alla stessa [Molare] della Hb. In assenza di BPG la p50 dell’Hb è 1 torr. In presenza di BPG sale a 26 torr. Quindi abbassa l’affinità dell’Hb di 26 volte. L’EMOGLOBINA FETALE CONTIENE DUE CATENE E DUE CATENE LE CATENE LEGANO IL 2,3-DIFOSFOGLICERATO MENO SALDAMENTE DELLE DUE CATENE CINETICA DI OSSIGENAZIONE DELL’EMOGLOBINA FETALE EMOGLOBINA S ANEMIA A CELLULE FALCIFORMI L’EMOGLOBINA S DIFFERISCE DALL’EMOGLOBINA NORMALE PERCHE’ NELLE CATENE (IN POSIZIONE 6) AL POSTO DELL’ACIDO GLUTAMMICO E’ PRESENTE LA VALINA La polimerizzazione della HbS attraverso le interazioni tra le catene laterali idrofobiche delle Val in posizione 6 e le tasche idrofobiche nei ripiegamenti EF delle catene in molecole adiacenti di Hb Ossi HbA Deossi HbA Ossi HbS Deossi HbS La deossiHbS polimerizza formando dei filamenti FORMAZIONE DI FIBRE DI DEOSSIEMOGLOBINA A CAUSA DELLA VALINA MUTATA FORMAZIONE DI FIBRE DI DEOSSIEMOGLOBINA ERITROCITI NORMALI ERITROCITI A FALCE
Scaricare