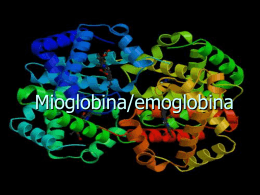
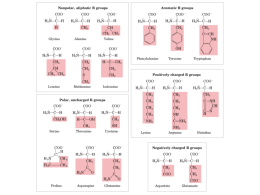
Fe-protoporfirina IX 141 153 La struttra terziaria, quella maggiormente legata alla funzione, evoluzionisticamente è più conservata di quella primaria. Il legame cooperativo dell’O2 all’Hb permette di trasportare una quantità di O2 1,7 (66/38) volte maggiore di quella che sarebbe trasportata se i siti fossero indipendenti. Modello sequenziale di una proteina allosterica Il legame di un ligando (L) ad una subunità modifica la conformazione di quella particolare subunità dallo stato T (quadrato) a quello R (cerchio). Questa transizione facilita, di volta in volta, il legame dei successivi ligandi alle altre subunità. Struttura quaternaria dell’emoglobina In seguito all’ossigenazione i dimeri 1 1 ed 2 2 ruotano di circa 15° uno rispetto all’altro. Posizione dello ione ferro nella deossiemoglobina In seguito all’ossigenazione, lo ione ferro si avvicina al piano dell’eme. Modificazionie conformazionale dell’emoglobina conseguente alla sua ossigenazione. Questo composto fortemente ionico, presente negli eritrociti ad una concentrazione circa uguale a quella della emoglobina (~ 2-4 mM), influenza in misura rilevante l’affinità dell’emoglobina per l’ossigeno. In assenza di 2, 3 BPG, l’emoglobina sarebbe un trasportatore di ossigeno estremamente inefficiente, poiché rilascerebbe solo l’8% del suo carico di ossigeno. Poiché l’emoglobina fetale non lega il 2,3 BPG così bene come quella materna, gli eritrociti fetali hanno un’affinità per l’ossigeno più alta di quella degli eritrociti materni. Es.Tessuto muscolare a riposo Es.Tessuto muscolare in attività 66% Quando l’emoglobina raggiunge una regione a pH più basso rispetto a quello dei polmoni, la sua tendenza a rilasciare ossigeno, già imputabile alla minore pO2 locale , aumenta.
Scaricare