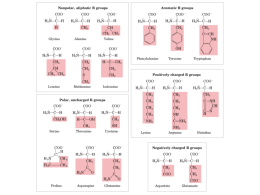
IL SANGUE • Tessuto connettivo fluido, rinchiuso in un sistema di canali comunicanti (vasi arteriosi e venosi) • Costituito da una parte liquida: plasma • e da elementi corpuscolati – globuli rossi o eritrociti – globuli bianchi o leucociti – piastrine o trombociti • Il volume di sangue presente in un individuo è circa il 7 - 8% del suo peso Composizione del sangue 55% plasma Acqua Proteine Lipidi Glucosio Aminoacidi Ioni ~1% globuli bianchi e piastrine 45% globuli rossi Albumine Globuline Fibrinogeno Neutrofili Linfociti Monociti Eosinofili Basofili ERITROCITI In natura esistono PROTEINE che interagiscono con l’O2 aumentandone la solubilità in acqua e sequestrandolo per trasportarlo. Nei mammiferi queste proteine sono : EMOGLOBINA Hb (P.M.: 66500 Dalton) MIOGLOBINA Mb (P.M.: 16500 Dalton) MIOGLOBINA SI TROVA: nelle cellule del MIOCARDIO e del MUSCOLO SCHELETRICO HA LA FUNZIONE: DI IMMAGAZZINARE L’O2 NEL CITOPLASMA E DI RILASCIARLO AI MITOCONDRI QUANDO NECESSARIO Rappresentazione della mioglobina EMOGLOBINA E’ CONTENUTA SOLO NEGLI ERITROCITI 3 FUNZIONI: 1. trasporta l’O2 dai polmoni ai tessuti periferici 2. trasporta la CO2 dai tessuti periferici ai polmoni 3. azione tampone sul pH del sangue !!! Nel sangue è necessario un TRASPORTATORE DELL’O2 perché questo gas non è abbastanza solubile da soddisfare le esigenze dell’organismo !!! PROPRIETÀ FISIOLOGICHE PRINCIPALI : 1. Si lega REVERSIBILMENTE con l’O2 Ossiemoglobina (HbO2) forma ossigenata Emoglobina ( o desossiemoglobina, Hb) forma non ossigenata 2. All’interno dei G.R. le molecole di O2 si legano e si dissociano dall’Hb in millisecondi Questa velocità è critica per il trasporto dell’O2, in quanto il sangue rimane nei capillari per meno di 1 secondo STRUTTURA DI MIOGLOBINA ED EMOGLOBINA 1. PARTE PROTEICA 2. UN GRUPPO PROSTETICO GLOBINA EME Sito di legame dell’O2 EME Derivato della porfirina, contente 4 anelli pirrolici È legato non covalentemente sia all’Hb che alla mioglobina Presenza di un atomo centrale di Fe++ POSSIBILI LEGAMI DELL’EME 1. H2O. Si originano Hb o Mb deossigenate 2. O2. Si origina ossiemoglobina (HbO2) 3. CO. Si origina carbossiemoglobina (HbCO). Legame 300 volte più stabile di quello con l’O2. SI LEGANO SOLAMENTE IN PRESENZA DI FE++. FE+++ NON è IN GRADO DI LEGARE CO E O2: MetHb metHb (Fe+++) + NADPH + H+ Hb (Fe++) + NADP+ QUANDO L’EME ISOLATO REAGISCE CON L’O2 IL FERRO PASSA IRREVERSIBILMENTE DALLO STATO FERROSO (Fe2+ ) A QUELLO FERRICO (Fe3+ ) PER EVITARLO DOBBIAMO UTILIZZARE UNA STRUTTURA PROTEICA GLOBINA GLOBINA la coordinazione del Fe2+ nella protoporfirina IX in una tasca idrofobica della globina permette il legame dell' ossigeno senza ossidazione del ferro a Fe3+ MECCANISMI DI LEGAME DELL’EME CON O2: La curva di saturazione per O2 L’affinità delle singole subunità per l’O2 dipende dallo stato di ossigenazione delle subunità adiacenti. Le quattro subunità dell’emoglobina interagiscono influenzandosi a vicenda, aumentando progressivamente l’affinità della proteina per l’ossigeno (cioè la facilità con cui l’ossigeno si lega). Il legame del primo ossigeno all’eme della prima subunità favorisce il legame del secondo ossigeno all’eme della seconda subunità; ciò favorisce il legame del terzo ossigeno e quindi del quarto. Questo comportamento è detto cooperatività positiva. LA CURVA STANDARD SI APPLICA SOLO ALLE SEGUENTI CONDIZIONI: 1. Hb umana di tipo A (HbA: è l’emoglobina presente nell’adulto) 2. pH = 7.40 3. pCO2 = 40 mmHg 4. T = 37 °C 5. [ 2,3- bifosfoglicerato]= 15µmol/g Hb A. AUMENTANO: l’affinità dell’Hb per l’O2 si riduce LA CURVA SI SPOSTA A Dx B. DIMINUISCONO: l’affinità aumenta LA CURVA SI SPOSTA A Sx ATTENZIONE! SI MODIFICA LA POSIZIONE non la forma MODIFICAZIONI DI POSIZIONE della curva MODULAZIONE DELL’AFFINITÀ DI Hb PER O2 EFFETTO DEGLI H+ : è dovuto ad una maggiore affinità di questi ioni per l’Hb desossigenata che per l’ossiemoglobina EFFETTO DELLA CO2: nel plasma la CO2 forma acido carbonico per cui determina modificazioni della [H+] EFFETTO DELLA TEMPERATURA: è quello tipico per tutti gli equilibri chimici: una temperatura più elevata favorisce la dissociazione tra Hb e O2, viceversa EFFETTO DEL 2,3- BIFOSFOGLICERATO (2,3-BPG): si lega con maggiore affinità all’Hb ridotta. Effetto del pH e della CO2 sull’affinità dell’emoglobina per l’O2 è noto come EFFETTO BOHR Forme di trasporto di CO2 nel sangue 1. Disciolta nel plasma (5-10% del totale) 2. Carbammato (5-10% del totale) 3. Bicarbonato (70-80% del totale) POTERE TAMPONE DELL’EMOGLOBINA: sinergia tra H+ e CO2 Il pKa è una misura della forza di un acido, della sua tendenza, cioè, a cedere un protone. Più piccolo il pKa, più forte l’acido Il pKa apparente dell’Hb dipende dal suo stato di ossigenazione in modo tale che Hb è un acido più debole di HbO2: (H+)2Hb « Hb + 2 H+ pKa » 7,8 (H+)2HbO2 « HbO2 + 2 H+ pKa » 7,0 • Nel sangue venoso, che è più acido, pKa > pH, l’Hb è in parte desossigenata, si combina con H+ e si oppone all’acidificazione causata dal rilascio di CO2 da parte dei tessuti. • Nel sangue arterioso, che è più basico, pKa < pH, l’Hb è completamente ossigenata (HbO2); pertanto rilascia H+ e si oppone all’alcalinizzazione causata dall’eliminazione respiratoria della CO2. EFFETTO BOHR Facilita il trasporto di CO2 come bicarbonato, perché fornisce H+ necessario per la sua formazione pH Affinità dell’Hb per O2 Rilascio O2 ai tessuti Hb(O2)4 + nH+ Hb(H+)n + 4O2 ( n di poco > 2 ) i protoni spostano la curva di dissociazione verso Dx promuovendo il rilascio di O2 RILEVANZA FISIOLOGICA DELL’EFFETTO BOHR La presenza di elevati livelli di CO2 e H+ nei capillari dei tessuti metabolicamente attivi determina il rilascio di ossigeno dall’Hb. Nei polmoni, invece, l’elevata concentrazione di ossigeno induce il distacco della CO2 e degli H+ dall’Hb. • La riduzione di pH sposta la curva verso Ds (minore affinità dell’Hb per O2) • L’aumento di pH sposta la curva verso Sn (maggiore affinità di Hb per O2 ) TEMPERATURA • L’aumento di T sposta la curva verso Ds (minore affinità dell’Hb per O2) • La riduzione di T sposta la curva verso Sn (maggiore affinità di Hb per O2 ) Il 2,3 -BIFOSFOGLICERATO • effettore allosterico negativo, la cui attività si somma a quella di CO2 e H+. • stabilizza la configurazione deossi dell'emoglobina. • viene allontanato dalla cavità solo in seguito all' ossigenazione. ADATTAMENTO AD ALTE QUOTE 1. Aumento della sintesi di Hb 2. Aumento della [2,3-BPG] negli eritrociti VARIANTI DELL’EMOGLOBINA La variante più comune è l’Hb fetale ( HbF ): è costituita da 2 catene α e 2 . (a2 2 ) Subito dopo la nascita le catene vengono sostituite dalle β. Interazione nulla con 2,3-DPG: ALTA AFFINITA’ PER O2 Catene 50% Catene Catene 25% 0% -9 Concepimento 0 Nascita 9 Mesi Cinetica di ossigenazione dell’emoglobina fetale VARIANTI PATOLOGICHE I. EMOGLOBINOPATIE: per indicare CAMBIAMENTI nella SEQUENZA AMINOACIDICA di una delle catene della globina II. TALASSEMIE: per indicare anomalie dovute a DIFETTI QUANTITATIVI nella produzione delle catene globiniche. EMOGLOBINOPATIE A SECONDA DI DOVE SI PRESENTA LA VARIAZIONE, CAMBIA IL TIPO DI PATOLOGIA 1. SOSTITUZIONE DI RESIDUI IN SUPERFICIE. Es. anemia falciforme (HbS) 2. SOSTITUZIONE DI RESIDUI INTERNI ALLA CATENA GLOBINICA. Formazione di precipitati con conseguente lisi e anemia emolitca. 3. 4. MODIFICAZIONI CHE STABILIZZANO LA FORMA OSSIDATA DELL’HB. Provoca cianosi SOSTITUZIONI NELL’INTERFACCIA FRA LE CATENE α E β. Stabilizzano la forma ossigenata e conseguente ipossia. Polimerizzazione HbS È una malattia ereditaria dovuta alla presenza nei GR della HbS. • Nelle catene β dell' HbS: acido glutammico (Glu 6) è sostituito da una valina (Val 6). • Falcizzazione: quando la pO2 scende sotto i 50-60 mmHg. La desossiemoglobina infatti è meno solubile tende a polimerizzare formando, all’interno dell’eritrocita, fasci di fibre tubulari insolubili. ERITROCITI NORMALI: FORMA BICONCAVA EMAZIE A FALCE Può essere presente in: OMOZIGOSI : la malattia si manifesta nel primo anno di vita con aumentata suscettibilità a contrarre infezioni, crisi dolorose, anemia emolitica cronica. SOLO IN OMOZIGOSI LE EMAZIE ASSUMONO LA FORMA A FALCE ETEROZIGOSI : la [HbS]~ 50%; ne conseguono due vantaggi: 1. non si verifica la falcizzazione per cui, solitamente, è asintomatica 2. protezione nei confronti della malaria in quanto crea condizioni non ottimali per la sopravvivenza del Plasmodio falciparum TALASSEMIE α-talassemia: – No espressione catena α, – Gravità della malattia: • ASSENZA DI UNA SOLA COPIA: stato di portatore silente (asintomatico) • ASSENZA DI DUE COPIE: alterazione ematologica lieve buon stato di salute • ASSENZA DI TRE COPIE: presenza nelle emazie di Hb formata da tetrameri di catene b (HbH = b4); quadro clinico grave • ASSENZA DI QUATTRO COPIE: CONDIZIONE INCOMPATIBILE CON LA VITA: MORTE INTRAUTERINA. In queste condizioni si forma scarsa quantità di Hb anomala in quanto formata da 4 catene (Hb Barts = 4 ) β-talassemia: – No espressione catena β, – Gravità della malattia: • MAJOR: Morbo di Cooley (b0 omozigote); anemia molto grave: il paziente necessita di continue trasfusioni di sangue altrimenti muore prima dell’adolescenza • INTERMEDIA: (b+ omozigote): quadro clinico ed ematologico di gravità intermedia tra la forma major e la minor • MINOR: (b0 eterozigote ): il paziente è affetto da anemia cronica non grave; non richiede trasfusioni • MINIMA: (b+ eterozigote ): paziente portatore del tratto talasssemico; manca ogni manifestazione clinica. TALASSEMIE E ANEMIA FALCIFORME RENDONO L’OSPITE RESISTENTE ALLA MALARIA DATI CLINICI: EMOGLOBINA GLICATA (HbA1c) Quando la concentrazione ematica del glucosio è elevata questo zucchero può reagire senza mediazioni enzimatiche con le proteine in una reazione detta “GLICAZIONE” Dipende dalla conc. di glucosio e dalla durata dell’iperglicemia Reazione lenta Hb + glucosio aldimmina chetoammina IMPORTANZA DELLA DETERMINAZIONE DELL’HbA1C NEL MONITORAGGIO DEL DIABETE!!! • La GLICEMIA consente una valutazione dello stato metabolico al MOMENTO DEL PRELIEVO • L’ EMOGLOBINA GLICATA permette una valutazione del controllo metabolico nelle 4-8 SETTIMANE PRECEDENTI IL PRELIEVO.
Scaricare