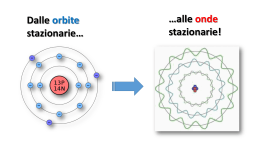
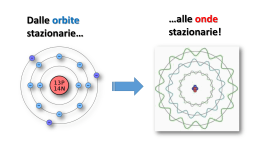
Rappresentazione dell’atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell’atomo e la distribuzione della massa concentrata nel nucleo Informazioni importanti circa la dimensione dell’atomo e la distribuzione della massa concentrata nel nucleo Rappresentazione dell’atomo di elio secondo Rutherford Il numero di elettroni doveva essere uguale a quello dei protoni. L’onda luminosa è una radiazione elettromagnetica che si propaga alla velocità della luce, le onde si caratterizzano attraverso l lunghezza d’onda e n frequenza Tipo di radiazione elettromagnetica Frequenza Lunghezza d'onda Onde radio ≤3 GHz ≥10 cm Microonde 3 GHz – 300 GHz 10 cm – 1 mm Infrarossi 300 GHz – 428 THz 1 mm – 700 nm Luce visibile 428 THz – 749 THz 700 nm – 400 nm Ultravioletti 749 THz – 30 PHz 400 nm – 10 nm Raggi X 30 PHz – 300 EHz 10 nm – 1 pm Raggi gamma ≥300 EHz ≤1 pm La luce bianca presenta uno spettro continuo Radiazioni assorbite Radiazioni emesse Rappresentazione di Bohr (1916) L’energia degli elettroni assume valori quantizzati, dipendenti dal raggio dell’orbita. h/2 = minimo momento angolare mvr = n(h/2) r = raggio dell’orbita v = velocità dell’elettrone m = massa dell’elettrone n = 1, 2, 3, … numero quantico h = costante di Plank A ciascun valore di n corrispondono valori definiti di r: 0,53 Å n = 1 2,12 Å n = 2 4,77 Å n = 3 e di energia: energia cinetica + energia potenziale che danno luogo a bande distanziate nello spettro di emissione dell’idrogeno. La presenza di bande fu spiegata da Sommerfield (1916) con l’ipotesi della presenza di orbite ellittiche, definite da numeri n ed l, assi dell’ellisse. n = numero quantico principale l = numero quantico angolare Ciò giustifica bande con livelli di energia vicine per lo stesso n. Un’osservazione più attenta delle righe dello spettro e la presenza di un doppio sdoppiamento di ciascuna riga dello spettro giustificò l’introduzione di un 3° ed un 4° numero quantico: m = 0, ±1, ±2, ±3,..±l, numero quantico magnetico s = +1/2, -1/2, numero quantico di spin. In realtà il modello planetario di Bohr non è applicabile ad atomi polielettronici e soprattutto a particelle con dimensioni così piccole; non si può dare una posizione precisa dell’elettrone, ma si può definire una regione di spazio. Principio di indeterminazione (Hisemberg -1927) Stabilisce che la posizione e la velocità di particelle piccole vengono date con una certa indeterminazione. x (posizione) vx (velocità) x ∙ vx = h/4m aumentando il valore della massa della particella l’indeterminazione perde significato. TEORIA ONDULATORIA Ripensando alle onde legate alle radiazioni, De Broglie (1924) descrive l’elettrone come: - onda di tipo progressivo (elettroni liberi); - onda stazionaria (elettroni intorno al nucleo) con lunghezza d’onda l a = circonferenza L’onda si estende nello spazio senza ruotare non c’è accelerazione e quindi emissione di energia. Le onde stazionarie sono descritte dall’equazione d’onda: d2f(x) 42 + f(x) = 0 dx2 l2 La posizione dell’elettrone viene data in termini probabilistici con una funzione d’onda tridimensionale: = (x, y, z) │2│ è proporzionale alla probabilità di trovare la particella in un determinato punto ed in un certo istante di tempo. L’andamento di questa funzione viene descritto dall’equazione di Schroedinger (1926): 2 + 82m/h2(E-V) = 0 operatore Laplaciano (somma di derivate parziali d2/dx2+ d2/dy2+ d2/dz2) E-V = energia cinetica Non essendo possibile determinare esattamente la posizione di una particella, l'equazione di Schroedingher dice invece dove è più probabile trovarla e dove è meno probabile: abbiamo cioè una distribuzione di probabilità.
Scaricare