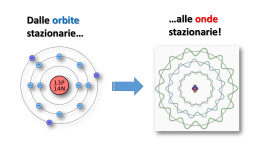
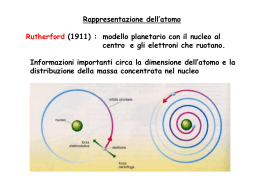
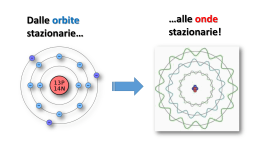
Dalle orbite stazionarie… …alle onde stazionarie! Le lacune nella teoria di Bohr Il modello atomico di Bohr spiegava bene le righe dello spettro dell'idrogeno, ma non riusciva a spiegare: 1. Tutte le righe degli spettri degli altri elementi (aventi più di un e- ). Analisi spettrografiche più approfondite, inoltre, rilevavano che diverse righe, in realtà, erano piccole bande di colore (cioè non erano costituite da un solo preciso colore, ma da un piccolo insieme di tonalità, di sfumature diverse ) 2. Le anomalie magnetiche degli spettri di molti atomi (avvicinando una calamita le righe si sdoppiano o, addirittura, si moltiplicano) Il numero quantico secondario l Sommerfeld, propose l’idea che non tutte le orbite siano perfettamente circolari, ma esistono orbite di forma ellittica e con varie, anche se ben definite, eccentricità, ognuna delle quali aventi una valore di energia leggermente diverso dalle altre (1916). Questo spiegava le diverse «sfumature» di colore presenti nelle bande. Il livello energetico (corrispondente ad una distanza indicativa r) individuato da Bohr fu indicato come numero quantico principale n (con valore da 1 a 7), mentre la diversa forma dell’orbita fu indicata come numero quantico secondario (o azimutale) l. Sommerfeld propose i seguenti valori di l nei rispettivi livelli n: 1) l=0 2) l=0, l=1 3) l=0, l=1, l=2 4) l=0, l=1, l=2, l=3 Sebbene i suoi calcoli prevedessero n-1 orbite possibili per un determinato livello n, i dati spettrali rilevati non indicavano l’esistenza di orbite con l >3 per i livelli superiori (5, 6, e 7). Il 3° numero quantico: l’orientamento magnetico m Altra «stranezza» degli spettri atomici (già conosciuta nel 1800 come effetti Zeeman) è quella che, in vicinanza di campi magnetici, molte righe spettrali si sdoppiano e altre addirittura si moltiplicano. Sappiamo che, durante il suo moto, l’e- genera un leggero campo magnetico (Oersted). Avvicinando una calamita, questa interagisce con il campo magnetico generato dall’eprovocandone uno spostamento, quindi una «deformazione» dell’orbita con variazione della sua ET (spostamento delle righe spettrali). Tale «deformazione» non è sempre la stessa, ma dipende dall’orientamento nello spazio della calamita e dell’orbita interessata. Se l’orbita si deforma, varia la sua ET. Ovviamente, allontanando la calamita, l’orbita riacquista la forma e l’ET originarie. Nessuna modifica Se l’orbita avente una determinata forma (numero quantico l ) fosse unica , la sua deformazione sarebbe evidenziata da un semplice spostamento (cambiamento di colore) di righe spettrali preesistenti Il fatto che alcune righe, invece, si moltiplicano può essere spiegato solo ammettendo l’esistenza di più orbite aventi stessa forma (stesso numero quantico l), ma orientamento spaziale differente: questo farà sì che il «disturbo» della calamita, risultando diverso per le varie orbite, fa assumere ET differenti producendo, appunto, l’effetto Zeeman. Si introdusse, perciò, un terzo numero quantico per indicare l’orientamento nello spazio di ogni orbita: fu chiamato numero quantico magnetico m. Per l’orbita circolare, l=0, fu trovato un solo numero quantico magnetico, m=0; per l =1 tre numeri quantici m=(-1 , 0, +1); per l =2 cinque numeri quantici m=(-2 , -1, 0, +1, +2); per l =3, sette numeri quantici m=(-3 , -2, -1, 0, +1, +2 , +3). Formula sintetica: m= da – l a + l (solo numeri interi compreso lo 0). Il 4° numero quantico lo spin s Altri «effetti magnetici» più lievi, responsabili di «sdoppiamenti» di tutte le righe spettrali, portarono a ipotizzare un ulteriore numero quantico, il numero quantico magnetico di spin s rappresentato come il verso di rotazione dell’elettrone attorno al proprio asse (orario o antiorario). A tale numero quantico s furono dati due valori s= +1/2 h ed s=-1/2 h dove h=costante di Planck. Nel 1925 Pauli dimostrò che nella stessa orbita (circolare o ellittica che sia) possono muoversi due elettroni purchè abbiano gli spin antiparalleli. Un terzo elettrone ne sarebbe escluso principio di esclusione di Pauli. La spiegazione è da ricercare nelle interazioni elettromagnetiche degli elettroni… Essendo di carica uguale due elettroni si respingerebbero per la forza elettrostatica di Coulomb, ma ruotando in senso inverso (spin antiparalleli) generano intorno campi magnetici aventi orientamento Nord-Sud che tendono a far attrarre gli elettroni. Forza elettrica e forza magnetica, così, trovano un equilibrio mantenendo gli elettroni sulla stessa orbita, ma a debita distanza l’uno dall’altro. Un terzo elettrone, oltre ad avere carica elettrica uguale agli altri due, si trova ad avere uno spin parallelo ad uno di essi. La situazione vedrebbe la repulsione avere la meglio sull’attrazione la sommatoria delle interazioni in gioco, infatti, risulterà una repulsiva (esclusione dall’orbita). Riassumendo… Atomo di Sommerfeld-Bohr L’elettrone percorre orbite stazionarie con momento angolare mvr=nh/2π che si possono trovare su uno dei 7 livelli energetici dell’elettrone numero quantico principale n (valori : 1,2,3,4,5,6,7) All’interno di ogni livello l’orbita può essere circolare oppure ellittica con specifica eccentricità Sottolivello energetico o numero quantico secondario l (valori da l =0 a l =n-1) Per le orbite ellittiche esistono diversi orientamenti nello spazio numero quantico magnetico m (valori da m= - l a m= + l , compreso m=0) In ogni orbita l’elettrone può avere rotazione attorno al proprio asse in senso orario o antiorario numero quantico magnetico di spin s (valori +1/2 h e -1/2 h). Dalle orbite alle… onde! De Broglie: un’altra idea rivoluzionaria Le continue modifiche e integrazioni miglioravano sempre di più il modello atomico di Bohr, ma non riuscivano a raggiungere la perfezione (corrispondenza perfetta tra equazioni, calcoli e previsioni secondo il modello BohrSommerfeld, e righe spettrali reali dei vari elementi). Peraltro in quei tempi vari esperimenti di laboratorio avevano fatto rilevare che i raggi catodici davano diffrazioni e interferenze paragonabili a quelle della luce! Gli elettroni sembravano comportarsi come i fotoni! Si cominciò a sospettare che anche gli elettroni avessero doppia natura come i fotoni: particellare e ondulatoria. Diffrazioni da un foro su un foglietto di alluminio Raggi X Si cercò di studiare e di capire, quindi, il comportamento ondulatorio dell’elettrone attorno al nucleo. Raggi catodici Interferenza da due fessure Quando si parla di onde, l’esperienza comune ci porta a pensare sostanzialmente ad un fenomeno periodico che, prodotto da una sorgente, si propaga nello spazio secondo determinate direzioni, disperdendo energia. Questo, tuttavia, non si verifica per le onde associate (o prodotte) dall’elettrone (almeno quando l’atomo è stabile , a riposo): lo dimostra l’assenza dell’annichilimento. Occorre, quindi, pensare ad una serie di onde «vincolate» a propagarsi intorno al nucleo e a non oltrepassare i confini dell’atomo. Significato dell’idea di De Broglie Per capire il concetto e comportamento di onde «vincolate» in un percorso, si può partire dallo studio di onde di esperienza comune. Quando diamo uno scossone (sorgente) ad una corda libera, si genera un’onda che «viaggia» lungo la corda fino all’altro estremo libero per poi «scomparire». Se lo facciamo su una corda fissata (vincolata) all’estremità, l’onda non scomparirà, ma rimbalzando, tornerà verso la mano. Se diamo una serie di scossoni, le onde di «andata» si incontreranno (interferiranno) con quelle di «ritorno»: si avranno punti in cui l’interferenza sarà costruttiva (in fase) alternati a punti dove sarà distruttiva (opposizione di fase). NODI Se la frequenza e l’ampiezza degli «scossoni» si mantengono costanti, data la loro uguaglianza, le onde (andata e ritorno) si incontreranno negli stessi punti e negli stessi modi: si generano onde stazionarie. Oscillazioni, cioè, che non si propagano lungo la corda, ma mantengono la stessa posizione. In particolare ci saranno punti, detti nodi, assolutamente fermi, e zone della corda oscillanti, dette ventri. Questo tipo di onde è molto comune: le corde della chitarra, o del violino ecc., generano serie di onde che, rimbalzando da un’estremo all’altro, producono, per interferenza reciproca, onde stazionarie. C’è un altro aspetto importantissimo: l’onda stazionaria potrà avere un numero di nodi e di ventri variabile, ma… … dividono la corda sempre in parti uguali. Questo si esprime affermando che un’onda stazionaria può assumere varie lunghezza d’onda λ, ma i suoi valori sono sottomultipli interi della λ massima (che dipende dalla lunghezza della corda) . La serie di onde stazionarie così ottenute viene definita serie delle armoniche. Torniamo al nostro atomo Tornando agli elettroni, dobbiamo immaginare onde che si muovo vincolate su corde non rettilinee ma circolari: le orbite, la cui lunghezze sono Lc =2πr. Tali onde, quindi, produrranno, per autointerferenza, onde stazionarie aventi λn= 2πr/n. Tali lunghezze d’onda saranno, cioè, solo sottomultiple della lunghezza dell’orbita. λ ben determinate Dalle onde agli… orbitali L’imprevedibilità del comportamento dell’elettrone. Riprendiamo le esperienze sui raggi catodici: Le figure di diffrazione attraverso fori piccolissimi si ottengono sia proiettando fasci di elettroni, sia proiettandoli uno ad uno sequenzialmente. Diffrazione attraverso un foro su foglio di alluminio Raggi X Raggi catodici (1) Interfaccia, (2) alimentatore per alta tensione (3) tubo per diffrazione degli elettroni (4) webcam Nel caso dell’interferenza la situazione ha addirittura dell’incredibile: ogni elettrone sembra «sdoppiarsi», passare da entrambe le fessure per poi ricombinarsi. Solo in questo modo è possibile spiegare le figure di interferenze a bande alternate, come quelle delle onde elettromagnetiche. Approfondiamo e cerchiamo di capire meglio. Agendo sulla tensione elettrica (voltaggio) del circuito, è possibile variare la velocità di emissione degli elettroni. Con velocità opportunamente bassa si può seguire nel tempo cosa succede su uno schermo sensibile, man mano che vi giungono gli elettroni. (La cosa risulta molto più difficile con la luce, data la sua altissima velocità) tempo - + A determinati intervalli di tempo, si potrà osservare qualcosa come nelle seguenti figure V Ripetendo l’esperienza, le posizioni degli elettroni cambiano, ma non cambierà il risultato finale: zone più dense alternate a zone meno dense. Stesso risultato si osserva se gli elettroni si proiettano a fasci, anziché singolarmente. t1 10 e- t2 200 e- t3 6000 e- t4 40000 e- t5 140000 e- Il trucco svelato Le figure ottenute si spiegano come il risultato della diversa posizione assunta dai vari elettroni che via via giungono (uno alla volta) sullo schermo: non c’è nessuno «sdoppiamento»! C’è un fatto strano, però: la posizione di ogni elettrone risulta casuale, imprevedibile, diversa ogni volta che si ripete l’esperienza, impossibile da conoscere prima del suo arrivo sullo schermo stesso. Risulta persino impossibile sapere quale delle due fessure possa attraversare, quindi fare previsioni esatte sulle traiettorie. Tuttavia, osservando meglio le figure… qualcosa è possibile determinare! la distribuzione delle «posizioni» sullo schermo non sembra, poi, del tutto casuale: esistono zone più dense e zone meno dense. Allora possiamo parlare di probabilità maggiori o minori di trovare l’elettrone, una volta «attraversate le fessure», in determinate zone o punti dello schermo e, quindi, di traiettorie più e meno probabili che esso può seguire. La disposizione di tali zone, inoltre, ricalca quasi fedelmente la posizione delle bande alternate delle onde elettromagnetiche quindi tale disposizione può essere «matematizzata» attraverso funzioni d’onda. Una funzioni d’onda, in sintesi, rappresenta la distribuzione sullo schermo di un insieme numerosissimo di elettroni che hanno attraversato il foro (o le fessure) Una funzione d’onda, relativa alla distribuzione degli elettroni sullo schermo dopo diffrazione o interferenza, descrive matematicamente la disposizione sullo schermo di moltissimi elettroni, quindi rappresenta un fenomeno collettivo… Ma quale significato può avere una funzione d’onda per il singolo elettrone? Esistono diverse interpretazioni, ne analizziamo due: Interpretazione statistica (Born e Einstein) La funzione d’onda è applicabile ad un insieme di particelle e ne rappresenta l’andamento statistico, collettivo. É perfettamente inutile, insignificante riferire la funzione alla singola particella. Interpretazione di Copenaghen o probabilistica (Bohr e Heisemberg) La funzione d’onda rappresenta tutte le possibilità (traiettorie e posizioni) di ogni singola particella. Tuttavia l’atto della rilevazione (misura) in un determinato istante mi permette di conoscere una sola di queste possibilità. Per capire Quando “sparo” un elettrone e questo interagisce con un ostacolo microscopico, posso prevedere che arriverà sullo schermo in una delle numerose possibili posizioni ricavate dallo sviluppo della funzione d’onda, posso indicare dove ha più probabilità di giungere, ma non posso sapere esattamente, con certezza assoluta il punto d’arrivo. Ancora se, dopo averlo sparato, rilevo una posizione sullo schermo e ne traccio la traiettoria seguita, non è detto che, ripetendo l’esperienza, alle stesse condizioni, venga seguita la stessa traiettoria per ritrovare l’elettrone nella medesima posizione sullo schermo. Potrebbe benissimo percorrere, in modo del tutto casuale e indipendente, un’altra traiettoria, pur tra quelle rispettanti la funzione d’onda (e sono molto numerose!) Queste ed altre interpretazioni, alternative o discendenti dalle prime due, concordano sul fatto che: Non è possibile «localizzare» il singolo elettrone che, per tal motivo, viene definito un’entità delocalizzata (o Non-localizzata) non ha, o non è possibile individuare per esso, un «luogo» fisico di esistenza definito. Heisemberg tradusse il concetto di Non-localizzazione dell’elettrone nel famoso Principio di Indeterminazione È impossibile conoscere contemporaneamente posizione e quantità di moto dell’elettrone. Fine modello deterministico Inizio modello probabilistico N.B. I concetti di Nonlocalizzazione, indeterminazione… valgono nel mondo «nanoscopico» (mondo dell’ultrapiccolo, sub-atomico). Nel consueto mondo «macroscopico» valgono ancore le teorie deterministiche di Newton-Maxwell. L’equazione d’onda di Shroedinger Con De Broglie ed Heisemberg si giunse alla conclusione che non esistono, per l’elettrone, orbite precise attorno al nucleo, ma solo zone di maggiore e minore probabilità in cui esso si può trovare nel tempo. Shroedinger tradusse queste idee in una complessa funzione matematica. Per curiosità, solo per curiosità, si riporta la formula con la simbologia specifica. Ciò che è importante è lo sviluppo matematico di tale funzione per il parametro ψ2 (psi al quadrato). Questo sviluppo (calcolando ψ2 per tutte le combinazioni dei numeri quantici di Bohr-Sommerfeld)) porta a risultati rappresentabili graficamente, su un piano tridimensionale, con zone di densità variabile (qualcosa di simile a nuvole, con parti più dense e parti meno dense). Tali zone furono nominati ORBITALI ATOMICI. Per Shroedinger (in linea con la Non-locabilità dell’elettrone) ogni orbitale rappresenta la distribuzione della carica elettrica dell’elettrone zone più dense=zone più cariche Per Bohr rappresenta la zona di probabilità di trovare l’elettrone in un dato momento zone più dense=zone più probabili (in linea con l’idea che l’elettrone sia, comunque, una particella localizzabile, almeno in un determinato istante) Orbitali atomici Attualmente si preferisce pensare l’orbitale ψ2 (funzione d’onda) come nell’interpretazione di Bohr, ma se preferiamo l’idea di De Broglie, dovremmo pensare ad un onda stazionaria vibrante non su una corda circolare, bensì su una sfera (passare da una rappresentazione bidimensionale a quella tridimensionale il «salto» di immaginazione è davvero arduo!) Per gli orbitali, risultanti dalla risoluzione della funzione d’onda ψ2 … la grandezza dipende dal numero quantico principale n la forma dipende dal numero quantico secondario l l’orientamento nello spazio dal numero quantico magnetico m Molti fisici e chimici anziché i valori numerici, al numero quantico secondario l preferiscono assegnare le lettere s,p,d,f mentre per i valori del numero quantico m, lettere varie come x,y,z,k,q ecc. Ogni orbitale possiede una ben determinata (quantizzata) energia che dipende solo dai primi due numeri quantici (n, l) e rispetta l’ordine seguente: I valor di energia sono correlati in modo inverso con le probabilità di ospitare elettroni. En. n 1<2<3<4<5<6<7 Prob. l s>p>d>f Prob. n 1>2>3>4>5>6>7 En. l s<p<d<f Orbitali atomici considerando il numero quantico secondario l (forma) e quello magnetico m (orientamento nello spazio) Orbitali atomici considerando tre numeri quantici (n, l, m) CONFIGURAZIONE ELETTRONICA Tenendo conto dei numeri quantici, delle interazioni elettromagnetiche e delle energie, quindi delle probabilità in gioco, nonchè dello sviluppo dell’equazione di Shroedinger, i vari elettroni tendono a disporsi attorno al nucleo, nei vari orbitali, secondo una configurazione che segue alcune regole: Regola dell’aufbau (dal tedesco «a strati») Gli elettroni tendono a sistemarsi negli orbitali a partire da quelli del livello energetico più basso (più probabile, più vicino al nucleo) a quello più alto (meno probabile, più lontano dal nucleo). Tale regola, troppo generale è, però, meglio rappresentata dalla regola della diagonale la quale, basata sullo sviluppo dell’equazione di Shroedinger, tiene in considerazione anche di qualche orbitale di un dato livello che risulta avere più energia, meno probabilità, di quelli del livello o dei livelli superiori. Principio di esclusione di Pauli In un orbitale (sottolivello) con un determinato orientamento (numero quantico magnetico m) può ospitare al massimo 2 elettroni che devono avere spin antiparallelo Principio della massima distribuzione di Hund Gli elettroni all’interno di un sottolivello tendono a sistemarsi occupando quanti più orbitali degeneri possibili (orbitali degeneri=orbitali aventi stessa probabilità, stessa energia) Solitamente la configurazione elettronica di un atomo può essere rappresentata tramite simboli alfanumerici… …o con un diagramma a caselle e freccette Rappresentazione della configurazione elettronica L’atomo di Shroedinger e i suoi orbitali I numeri quantici dell’atomo quantistico di Bohr–Sommerfeld ( livello energetico n, sottolivello l, numero quantico magnetico m, numero quantico di spin s) rimangono validi, ma non si ammettono più orbite (traiettorie) per l’elettrone. Al loro posto si parla di orbitali. Per lo stesso Shroedinger ogni orbitale ψ2 rappresenta semplicemente la distribuzione nello spazio attorno al nucleo della carica negativa dell’elettrone: più densa è la zona, più concentrata è la carica in tale zona e viceversa. Per Heisemberg e Bohr ogni orbitale ψ2 rappresenta la distribuzione nello spazio delle probabilità di trovare l’elettrone in un dato momento attorno al nucleo: nelle parti più dense è maggiore. Ad esempio, che lo sviluppo di ψ2 per l’unico elettrone dell’idrogeno permette di ottenere risultati moltissimo addensati a formare una sorta di circonferenza attorno al nucleo con raggio circa 0,5 Angstron. Il dato combacia con il valore del raggio della presunta orbita trovato anni prima da Bohr. Questo rafforzò l’opinione che a quella distanza è altissima (più del 90%) la probabilità di trovare l’elettrone in un dato istante o, nell’idea di Shroedinger, è densissima la sua carica negativa. Relativamente al nucleo e alle altre particelle subatomiche… nessuna novità sostanziale: Z numero atomico=numero di protoni (identificativo della specie atomica) A numero di massa= somma dei protoni e dei neutroni I raggi protoni e neutronici manifestano analoghi comportamenti ondulatori e indeterministici dei raggi catodici. Il nucleo mostra equilibri precari (radioattività) e contenuti energetici enormi (energia nucleare). Nessuna ipotesi degna di rilevanza circa l’organizzazione, la struttura e gli equilibri all’interno del nucleo fino al 1964, quando fu ipotizzata l’esistenza dei quarks Modello Standard Dalton 1803 Thomson 1904 Rutherford 1911 Bohr 1913 Sommerfeld 1916 De Broglie 1924 Modello standard 1967/68 Shroedinger 1926 Qualche riflessione… L’atomo quantistico di Bohr-Sommerfeld ricorre ad una teoria che oggi definiamo semi-classica in quanto le leggi utilizzate erano in sostanza quelle della meccanica classica, quella cioè di Newton-Maxwell (definita deterministica), con l’aggiunta di condizioni quantistiche. L’atomo di De Broglie-Heisemberg-Shroedinger ricorre a leggi nuove: quelle della meccanica quantistica (o ondulatoria o probalistica) che non è deterministica (pensate alla «delocalizzazione» dell’elettrone …!). Le teorie della fisica quantistica hanno rivoluzionato il modo di concepire la realtà e risultano sconvolgenti non tanto per la non applicabilità della meccanica classica di Newton-Maxwell (ritenuta tutt’ora valida per il mondo macroscopico) al mondo sub-atomico, quanto per le implicazioni della non-locabilità di ciascuna particella e del suo stato fisico inteso come il risultato di specifiche combinazioni probabilistiche, tra numerose possibili. • Così, ad esempio, è incomprensibile che un oggetto come una palla, di cui si possono determinare e prevedere, con assoluta certezza, posizione, velocità, peso, colore ecc… sia completamente costituita da particelle non localizzabili, il cui stato non è determinato, se non nel solo momento della loro osservazione. • E’ anche sconvolgente sapere che un oggetto e il suo stato chimico-fisico siano solo il risultato di una serie di combinazioni casuali tra le tantissime possibili. Shroedinger, per far capire a colleghi e studenti la «portata» inquietante di questa rivoluzione scientifica, che prevede l’indeterminabilità di un evento particellare, ideò un esperimento concettuale. Sostanza radioattiva: emette in media 1 particella/ora Dopo un’ora, il gatto è vivo o è morto? Dato che non è possibile determinare con esattezza se la particella sia stata emessa o no, occorre valutare l’evento in modo statistico: lo sviluppo del calcolo probabilistico (La funzione ψ) porta ad affermare che: gatto vivo e gatto morto non sono condizioni fisiche esistenti allo stato puro, bensì sono perfettamente miscelati, quindi la risposta esatta è… Gatto vivomorto. L’osservazione diretta (apertura della scatola), tuttavia, «manifesterà» uno dei due stati possibili in modo casuale, non prevedibile. Scatola chiusa La particella colpisce la leva che «scatta» in giù Cianuro La leva fa cadere il martello La fiala si rompe Einstein non era per niente d’accordo con queste convinzioni indeterministiche della realtà. Di lui rimase una frase storica: «Dio non gioca a dadi!»
Scaricare