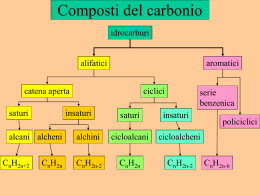
CHIMICA ORGANICA La Chimica Organica è la chimica del carbonio. In chimica organica il carbonio forma sempre in totale 4 legami che possono essere di varia natura. 4 legami semplici C C 1 legame doppio e 2 semplici = 4 legami C 1 legame triplo e 1 semplice = 4 legami Il carbonio può formare legami di vario genere con ossigeno, azoto, idrogeno, zolfo, alogeni, altri elementi o con altri carboni. C H C Cl C O H H C N C C C O H ATTENZIONE: in questi esempi il C ha 1 solo legame e ne deve formare altri 3, ma O, N, Cl e H hanno il massimo dei legami che possono formare. Nel caso del C=O il carbonio forma due legami sotto forma di 1 doppio legame. Gruppi funzionali I composti organici possono essere classificati in base a specifiche caratteristiche strutturali identificate con il nome di gruppo funzionale, la cui definizione è quella di una porzione di molecola che ha un comportamento chimico specifico e che permette alla molecola intera di essere classificata in una data classe di composti. IDROCARBURI molecole costituite solo da carbonio e idrogeno. Gli idrocarburi si chiamano SATURI quando tutti i carboni della catena della molecola formano legami semplici e INSATURI quando il carbonio forma legami doppi o tripli. - ALIFATICI : Alcani Alcheni Alchini - AROMATICI Alcani Formula generale: CnH2n+2 con n=1,2,3… covalenti semplici C – C detti legami σ perché coinvolgono orbitali di tipo s. • legami In base al numero di atomi di C nella molecola si ha la seguente nomenclatura: 1atomo C: met - 2 atomi C: et 3 atomi C: prop 4 atomi C: but 5 atomi C: pent 6 atomi C: es - Desinenza: -ano H H C H 1 carbonio H H H H C H C H H H 2 carboni Etano C2H6 CH3CH3 Metano CH4 3 carboni H H H H C C H C H H H Propano C3H8 CH3CH2CH3 H H H H H H C C C H C H H H H Butano C4H10 CH3CH2CH2CH3 H 4 carboni Metano: Metano: una delle molecole organiche più semplici I quattro legami semplici del carbonio determinano i vertici di un tetraedro Gli atomi di C, con i loro atomi di H attaccati, possono legarsi tra loro in catene di varia lunghezza per formare composti Etano Propano La catena di atomi di Carbonio delle molecole organiche è chiamata scheletro carbonioso Le catene carboniose variano in lunghezza Le catene carboniose possono essere lineari o ramificate Questi composti hanno la stessa formula grezza (in questo caso C4H10), ma differente formula di struttura e per questo proprietà diverse. Butano Isobutano C4H10 C4H10 Composti con la stessa formula grezza ma differente struttura sono detti isomeri PROPRIETA’ FISICHE: insolubili in acqua e solubili in sostanze organiche apolari come benzene, cloroformio • • meno densi dell’acqua • hanno basso punto di fusione e di ebollizione che aumentano con l’aumentare del numero di atomi di C nella molecola • fino a 4 atomi di C sono gas, poi liquidi fino a 16 atomi di C e gli altri sono solidi. PROPRIETA’ CHIMICHE: • poco reattivi poiché i legami C-C e C-H sono molto forti • non hanno gruppi funzionali REAZIONI DEGLI ALCANI: DEIDROGENAZIONE Per eliminazione di atomi di idrogeno gli alcani originano idrocarburi insaturi: alcheni e alchini REAZIONI DEGLI ALCANI: COMBUSTIONE Comunemente gli alcani possono essere chiamati paraffine. una reazione classica degli alcani che è quella di combustione (usata nei motori a scoppio e forni), in cui l’alcano funge da combustibile e l’ossigeno da comburente. La reazione produce acqua e anidride carbonica oltre che una grande quantità di calore. CH4 + 2O2 CO2 + 2H2O + 890 kJ REAZIONI DEGLI ALCANI: CRACKING Consiste nella rottura delle catene per ottenere alcani a breve catena –materia prima per le sintesi industriali- poi separati per distillazione frazionata. Il petrolio è un liquido denso, viscoso,costituito da migliaia di componenti, principalmente idrocarburi, formatosi per decomposizione di antiche specie marine e vegetali. Le raffinerie producono composti utili dalle migliaia di differenti idrocarburi presenti nella miscela. Il processo di separazione nella raffinazione è rappresentato da una distillazione frazionata. Le frazioni sono le seguenti: 1) I gas che bollono al di sotto dei 20 °C e sono idrocarburi come propano, butano e isobutano che possono essere liquefatte a t.a. e raccolte in bombole (GPL che si usa in cucina o per riscaldare ambienti). 2) Le nafte, idrocarburi con p.e. 20200 °C (che rappresenta la fonte principale della benzina). 3) Il cherosene, idrocarburi da C9 a C15 con p.e. 175-275 °C. 4) L’olio combustibile, idrocarburi da C15 a C18 con p.e. 250-400 °C. E’ il carburante per i motori diesel. 5) L’olio lubrificante e combustibile pesante °C idrocarburi p.e. superiori a 350 °C. 6) L’asfalto è il residuo nero, catramoso che si ottiene dopo rimozione di tutte le frazioni volatili. La benzina è una miscela complessa di idrocarburi da C6 a C12 CICLOALCANI Sono alcani ciclici, la catena carboniosa è chiusa. Si chiamano aggiungendo il prefisso ciclo al nome dell’alcano. Il cicloalcano più semplice è il ciclopropano con tre atomi di C. Gli idrocarburi ciclici possono essere rappresentati ediante poligoni regolari: Ciclopropano H Ciclobutano H H C H C Ciclopentano H H C H H H H C H H C C H H C C H H H C C H H H H C H C C H H H H C H H H Cicloesano C H C H H C C H H H H ALCHENI H CH2 CH2 C H H H H H H H C Etene C2H4 Gli alcheni sono idrocarburi che contengono lungo la catena uno o più doppi legami carbonio-carbonio. Per questo motivo gli alcheni sono classificati come idrocarburi insaturi. Il doppio legame è formato da uno σ e uno π perché coinvolge orbitali p. Formula generale: CnH2n con n=2,3,4… Stessi prefissi degli alcani + Desinenza: -ene PROPRIETA’ FISICHE: Come gli alcani • non sono solubili in acqua ma in solventi apolari. • hanno punti di fusione e di ebollizione bassi • primi sono gas, poi liquidi e solidi all’aumentare dei C nella catena PROPRIETA’ CHIMICHE: • il legame π è debole, pertanto quando si rompe la molecola può legare altri atomi. REAZIONI DEGLI ACHENI 1) IDROGENAZIONE Facendo reagire un alchene con H2 ottengo un alcano 2) IDRATAZIONE Facendo reagire un alchene con H2O ottengo un alcool REAZIONE DI POLIMERIZZAZIONE gli alcheni reagendo possono formare polimeri. Un polimero è una grossa molecola organica costituita dalla ripetizione di un elevano numero di molecole più semplici chiamate MONOMERI. FIBRE: polimeri filati come, seta, nylon, cotone MATERIE PLASTICHE: sottili pellicole (per alimenti) solidi duri materiale per rivestimento (vernici, lucidi) IL POLIPROPILENE Giulio Natta, Nobel per la CHIMICA 1963 per la sintesi del polipropilene Il polipropilene ha avuto grande successo nell’industria della plastica: molti oggetti di uso comune sono fatti di polipropilene. POLIMERI NATURALI: Amido Cellulosa Proteine Cacciù (gomma naturale) POLIMERI ARTIFICIALI Polietilene Polivinilcloruro (PVC) Polistirene o polistirolo Polipropilene Teflon Plexigas ALCHINI 1 HC 2 Etino o acetilene 2 CH 1 2 3 HC CCH3 1 Propino Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carbonio-carbonio e sono anch’essi classificati come idrocarburi insaturi. Un legame σ e due π Formula generale: CnH2n-2 con n=2,3,4… Desinenza: -ino ALOGENURI ALCHILICI I composti in cui uno o più alogeni sono legati ad atomi di carbonio sono chiamati alogenuri alchilici e, indicando genericamente con X l’alogeno che può essere F, Cl, Br o I, rispondono alla formula generale R-X. Cl H H C Br F C Cl H F Bromometano Diclorodifluorometano H H I C C H H Iodoetano H Il bromuro di metile è un pesticida molto utilizzato e si usa spesso nel trattamento del suolo prima della semina. E’ un prodotto che si ottiene a basso costo ed è efficace verso una grande varietà di organismi nocivi. Il problema del suo uso è che è una sostanza che distrugge l’ozono, la molecola presente nella stratosfera che fa da schermo ai raggi ultravioletti solari. CH3Br Bromuro di metile O O Ozono O I clorofluorocarburi (CFC, nome commerciale Freon) non sono tossici, non infiammabili, inodori e non corrosivi e perciò sono usati come mezzo di trasferimento del calore nei sistemi di refrigerazione. Tuttavia i CFC risultano già da tempo dannosi per l’ambiente poiché distruggono l’ozono stratosferico. Infatti stazionano nell’atmosfera senza decomporsi per poi salire verso la stratosfera e reagire con l’ozono. Al momento si tende a sostituirli con gli idrofluorocarburi (HFC) e gli idroclorofluorocarburi (HCFC). CH2FCF3 HCF-134a CCl3F Triclorofluoro metano Freon-11 CCl2F2 Diclorodifluoro metano Freon-12 CHCl2CF3 HCFC-123 ALCOLI Gli alcoli sono i composti con cui lo studente ha, sicuramente, la maggiore familiarità (Es: etanolo, metanolo) e il loro gruppo identificativo (gruppo funzionale) è un ossidrile (-OH) legato a un gruppo alchilico R. In generale un alcol può essere rappresentato nel seguente modo: Gruppo alchilico R-OH H H C H OH Metanolo oppure Alcol metilico H Gruppo ossidrilico H H C C H H Desinenza: -olo OH Etanolo oppure Alcol etilico ALCOLI gruppo ossidrilico R - OH lone pairs H O C sp3 sp3 La presenza di un atomo di H legato all’O rende possibile la formazione di ponti a H intermolecolari primario H3C—CH2 —OH etanolo secondario terziario OH | H3C—CH —CH3 OH | H3C—C —CH3 | CH3 2-propanolo ter-butanolo 2-metil-2-propanolo ALCOLI I composti che possiedono due, tre o più gruppi alcolici (-OH) sono classificati come polioli e il suffisso da usare sarà -diolo (2 -OH), -triolo (3 -OH) ecc. OH OH OH OH OH CH2 CH2 CH2 CH CH2 2 3 1 2 1,2-etandiolo oppure Glicole etilenico 1 1,2,3-Propantriolo oppure Glicerina, glicerolo Il glicole etilenico è usato come anticongelante grazie al suo basso punto di congelamento. HOCH2CH2OH L’ossidazione dell’etanolo ad acido acetico con dicromato di potassio è alla base del saggio di controllo dell’alcol nell’alito utilizzato dalla polizia stradale per determinare il controllo di alcol nel sangue di una persona.Il test si basa sulla differenza di colore tra lo ione dicromato (rosso-arancio) del reagente e lo ione cromico III (verde) del prodotto.Come l’alito contenente vapori di etanolo passa attraverso il tubo, lo ione dicromato, arancio rossiccio, si trasforma in ione cromico III, verde. O CH3CH2OH + (Cr2O7)2ione dicromato (rosso-arancio) CH3COH + Cr3+ ione cromico (verde) PROPRIETA’ CHIMICO – FISICHE DEGLI ALCOOLI • Caratterizzati da parte polare (gruppo –OH) e parte apolare (catena carboniosa). • formano legami a idrogeno con l’acqua • la solubilità in acqua diminuisce all’aumentare dei C nella catena • punti di fusione e di ebollizione più alti degli idrocarburi • come l’acqua sono sostanze anfotere, possono comportarsi sia da basi che da acidi. Gli alcoli sono acidi molto deboli. H C H H O H H H O H C H H O H H O H Reazioni di sintesi degli alcoli Idratazione di alcheni in ambiente acido Reazione di un alcol primario con acido alogenidrico ClR R R + Cl + R + Cl R H C H H+ Cl R H C H O O H H H Cl- R H C H O H H H2O Cl H C R H Reazione di un alcol terziario con acido alogenidrico R R R ClH+ R C Cl R C R C OH H2O R R R R1 + R3 R2 + R1 R3 R2 R1 + R3 + Cl- R2 R1 R1 + Cl R2 R3 R3 R2 Cl L’alcol terziario viene protonato dall’acido. L’alcol terziario protonato perde una molecola di acqua e viene attaccato dallo ione cloruro. REAZIONI: DISIDRATAZIONE DI UN ALCOOL PRIMARIO Dalla reazione di disidratazione di un alcool in ambiente acido si ottiene un alchene. Esempio: per eliminazione di H2O dall’etanolo si ottiene l’etilene. Reazioni di ossido-riduzione carbonile (aldeide o chetone) alcol N.B. carbossile alcol 1° aldeide carbossile alcol 2° chetone X alcol 3° X
Scaricare