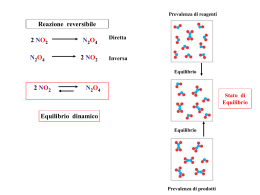
REVERSIBILITA’ DELLE REAZIONI ED EQUILIBRI CHIMICI Solubilizzazione del carbonato di calcio in ambiente acido CaCO3 (s) + CO2 (aq) + H2O (l) Ca2+ (aq) + 2HCO3- (aq) CaCO3 Ca2+ (aq) + 2HCO3- (aq) CaCO3 (s) + CO2 (g) + H2O (l) Precipitazione del carbonato di calcio Data la reazione generica: A+B C concentrazione Seguendo nel tempo le variazioni di concentrazione dei reagenti e prodotti, osseviamo: Regione di equilibrio Regione cinetica tempo tetrossido d’azoto 2 NO2 N 2O 4 concentrazione concentrazione biossido d’azoto NO2 N 2 O4 NO2 tempo N.B. N 2 O4 tempo indipendentemente dal fatto che si parta dal 100% di reagente (NO2) o dal 100% del prodotto N2O4 all’equilibrio avremo sempre lo stesso rapporto di concentrazioni. L’equilibrio chimico è una condizione dinamica Situazione iniziale Situazione all’equilibrio NO2 N2O4 NO2 Statisticamente avremo 2 molecole di NO2 e 4 di N2O4 LEGGE DELLE AZIONI DI MASSA (SISTEMI CHIUSI) aA + bB cC + dD [C]c [D]d Costante di equilibrio = K = [A]a [B]b Esempio: H2 (g) + I2 (g) 2 HI (g) H2 (g) I2 (g) HI (g) Concentrazioni iniziali 0.0175 0.0175 0 Variazioni delle concentrazioni nel raggiungimento dell’equilibrio -0.0138 -0.0138 +0.0276 Concentrazioni all’equilibrio 0.0037 0.0037 0.0276 [ HI]2 [H2][I2] = (0.0276)2 = (0.0037)(0.0037) 56 Principio di Le Chatelier Se un sistema all’equilibrio subisce una alterazione il sistema reagirà in modo da annullare, almeno in parte, l’alterazione subita. • Modificazione della concentrazione di un reagente o di un prodotto • Modificazione della temperatura • Modificazione della pressione o del volume Principio di Le Chatelier • Modificazione della concentrazione di un reagente o di un prodotto Consideriamo la generica reazione : A + B C partendo con 20A e 20B si perviene all’equilibrio: 10 A + 10 B [C] K= _______ [A] [B] 10 C [10] = __________ = 0.1 [10] [10] Immaginiamo di aggiungere 5 C alla miscela in equilibrio 10 A + 10 B 10 C Quello che accade è che delle 5 molecole di C 2 vengono convertite in 2 A e 2B generando il nuovo equilibrio: 12 A + 12 B 13 C [13] K= __________ [12] [12] 0.1 I2 + H2 2 HI Partendo dal sistema all’equilibrio: Se aggiungiamo un extra quantità di I2 il sistema reagirà aggiustando le concentrazioni delle specie chimiche ristabilendo un nuovo equilibrio con la stessa Ke - H2 + I2 I2 + H2 Se rimuoviamo un po’ di H2 ,di nuovo, il sistema reagirà aggiustando le concentrazioni delle specie chimiche ristabilendo un nuovo equilibrio con la stessa Ke 2 HI I2 + H2 2 HI Esempio – trasporto dell’O2 nel sangue equilibrio Il trasporto dell’ossigeno da parte dell’emoglobina è un esempio di adattamento continuo dell’equilibrio alle differenti condizioni ambientali Nei polmoni vi è abbondanza di ossigeno quindi: L’equilibrio è spostato a destra e l’ossigeno è legato all’emoglobina Quando il sangue raggiunge le cellule, dove vi è carenza di ossigeno: L’equilibrio si sposta a sinistra, e l’ossigeno viene rilasciato dall’emoglobina Se ad esempio: Il rapporto della forma ossigenata rispetto alla deossigenata è: Se la solubilità dell’O2 nel sangue a 37°C= 0.1 M : nei polmoni Nei capillari, il livello di O2 è circa 0.001M e quindi: Dipendenza dell’equilibrio dalla temperatura: •Se una reazione è esotermica un aumento della temperatura sposta a sinistra (verso i reagenti) l’equilibrio e la Ke diminuisce. •Se la reazione è endotermica un aumento della temperatura sposta a destra (verso i prodotti) l’equilibrio e la Ke aumenta. Tale comportamento comune alla maggior parte delle reazioni può essere spiegato immaginando il calore come una specie di reagente. A + cal A B B + cal Reazione endotermica Reazione esotermica + cal A + cal A B + cal B + cal Data una reazione generica aA + bB cC + dD il quoziente di reazione è definito dall’equazione [ C ] c [ D ]d Q= [ A ]a [ B ] b N.B. L’espressione matematica di Q ha l’aspetto di una espressione di equilibrio ma differisce da Keq perché le concentrazioni che vi compaiono non sono necessariamente le concentrazioni all’equilibrio A B B A A B B A 4A 4B A A A 4A B B A B B 4B C D D C C D D D C C D C D C C D 8C Keq= 8D C D D C C D D D C C D C D C C D 8C A+B C + D 8D Non accade niente [C][B] [A][B] = (8)(8) (4)(4) =4 C D C D D D D D B C C A C A B A C C D C B D A 4A B 4B 8C 8D concentrazioni di reagenti e prodotti non all’equilibrio [C][B] (10)(10) Q = = = 25 [A][B] (2)(2) quoziente di reazione A B B A 2A A A 2A 2B B B 2B C C D DD C C D D D C C C C D D C C D D 10 C 10 D C C D DD C C D D D C C C C D D C C D D 10 C 10 D C D C D D D D D B C C A C A B A C C D C B D A 4A B 4B [C][B] [A][B] = 8C (8)(8) (4)(4) 8D = 4 = Keq concentrazioni di reagenti e prodotti non all’equilibrio [C][B] (6)(6) Q = = =1 [A][B] (6)(6) quoziente di reazione A B A A A A A B B B B B 6A 6B A A A A A A 6A B B B B B B 6B C C C C C C 6C C C C C C C 6C D D D D D D 6D D D D D D D 6D C D C D D D D D B C C A C A B A C C D C B D A 4A [C][B] [A][B] B 4B = 8C (8)(8) (4)(4) 8D = 4 = Keq Relazione tra quoziente di reazione e costante di equilibrio 1. Se Q < K, il sistema non è all’equilibrio e avviene la reazione Reagenti Prodotti 2. Se Q = K, il sistema è all’equilibrio 3. Se Q > K, il sistema non è all’equilibrio e avviene la reazione Prodotti Reagenti VARIAZIONE DI ENERGIA LIBERA NEL CORSO DI UNA REAZIONE Energia libera G A+B A+B C+D GREAGENTI = GA + GB DG = GPRODOTTI – G REGENTI GPRODOTTI = GC + GD 100% reagenti Coordinate di reazione C+D 100% prodotti GX = G°X + R T ln[X] R = costante universale dei gas = 8.314 J/(mol.K) T = temperatura assoluta= 273.15 + °C quando [X] = 1 GX = G°X G° = energia libera in condizioni standard Condizioni standard pressione= 1 atmosfera temperatura = 25 °C concentrazione unitaria 1 M per soluzioni 1 per sostanze allo stato liquido o solido N.B. l’importanza della equazione è che ci permette di calcolare la l’energia libera di una sostanza in condizioni non standard (attuali) Energia libera G A+B GREAGENTI = GA + GB DG = GPRODOTTI – G REGENTI GPRODOTTI = GC + GD 100% reagenti Considerando che GX = G°X + R T ln[X] Coordinate di reazione C+D 100% prodotti DG = DG° + RT ln([C]c[D]d) / ([A]aB]b) La variazione DG rappresenta la variazione di energia libera in funzione delle concentrazioni attuali dei reagenti e prodotti DG = DG° + RT ln([C]c[D]d) / ([A]aB]b) se ([C]c[D]d) / ([A]aB]b) = Q DG = DG° + RT ln Q quando [A]; [B]; [C]; [D] = 1 ln 1 =0 DG = DG° variazione di energia libera in condizioni standard, cioè quando reagenti a concentrazione di 1 M vengono convertiti completamente in prodotti. quando il sistema è all’equilibrio ([C]c[D]d) / ([A]aB]b) = Keq non produce trasformazioni nette spontanee e quindi DG = 0 = DG° + RT ln K - DG° = RT ln K da cui K = e –DG°/RT quindi noto il DG°RXN standard è possibile calcolare la Keq Andamento di come variano i parametri termodinamici (energia libera, entalpia, entropia) trasformano reagenti in prodotti, per la reazione generica R -> P condizione di equilibrio Relazione tra DG° e Keq A+B C+D La reazione è a favore dei prodotti DG° < 0, K >1 Energia libera G A+B DG° < 0 Q<K C+D Q>K Q=K 100% reagenti Sistema all’equilibrio Coordinate di reazione 100% prodotti A+B Relazione tra DG° e Keq C+D La reazione è a favore dei reagenti DG° > 0, K <1 Energia libera G C+D DG° > 0 Q>K A+B Q<K Q=K 100% reagenti Sistema all’equilibrio Coordinate di reazione 100% prodotti A+B C+D DGA+BC+D = DG° + RT ln Q DG = DG° +2.3 RT log Q Es.: DG°=10 KJ/mole, R=8.314 J/mol K, T= 273+25°C DG>O reazione endoergonica 30 DG=0 25 -DG°/2.3RT Q= Keq= 10 = 0.0177 20 D G (KJ/mole) 15 10 Q=1 D G = D G°= 10 KJ/mol 5 0 1E-04 0,001 0,01 0,1 1 10 -5 -10 -15 -20 DG<O reazione esoergonica Q (scala logaritmica) 100 1000 10000 CH2PO32H O OH H OH HO H H OH Glucoso 6P [0.665] CH2PO32O CH2OH H H OH HO DG° = + 1.7 KJ/mol OH Fruttoso 6P [0.335] Calcolando la Keq: K= e-DG°/RT = e-1700/(9.314x298) = 0.504 = ([F6P]/[G6P])eq Essendo K < 1 la reazione prevede un equilibrio spostato a sinistra Se [F6P] + [G6P] = 1 [F6P] =0.335, [G6P] =0.665 N.B. Nella realtà biochimichica le [ ] non sono all’equilibrio (la cellula è un sistema aperto) e le variazioni di energia libera devono essere espresse in termini di DGattuale DG = DG° + RT ln Q = 1.7+ RT ln[F6P]/[G6P] 1 0.8 Glucosio 6 P 0.6 0.4 CH2PO32 - 0.2 0 H H O + 15 Glucoso 6P H OH OH HO OH DG, KJ/mol H + 10 +5 CH2PO32 CH2OH - O Fruttoso 6P H 0 - 1.72 H Sistema all’equilibrio OH HO OH -5 Condizioni in stato-stazionario intracellulare - 10 CH2PO32 O 0 0.2 0.4 0.6 Fruttosio 6 P 0.8 1 Fruttoso 1,6bis P H H - 15 CH2PO4 - HO OH OH Sistema isolato Tende a raggiungere l’equilibrio G6P/F6P= 0.5 = Keq Sistema aperto Tende a mantenere uno stato stazionario G6P/F6P= 0.25 = Qstato stazionario
Scaricare