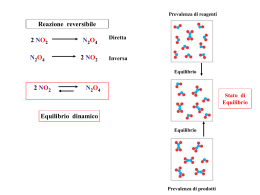
Equilibrio chimico • • • • Equilibri dinamici Legge azione di massa, Kc, Kp,… Equilibri eterogenei Principio di Le Chatelier Data la reazione generica: A+B C concentrazione Seguendo nel tempo le variazioni di concentrazione dei reagenti e prodotti, osseviamo: Regione di equilibrio Regione cinetica tempo biossido d’azoto NO2 N 2 O4 N 2 O4 NO2 Tempo N.B. N 2 O4 concentrazione concentrazione 2 NO2 tetrossido d’azoto Tempo indipendentemente dal fatto che si parta dal 100% di reagente (NO2) o dal 100% del prodotto N2O4 all’equilibrio avremo sempre lo stesso rapporto di concentrazioni. L’equilibrio chimico è una condizione dinamica Situazione iniziale Situazione all’equilibrio NO2 N2O4 NO2 Statisticamente avremo 2 molecole di NO2 e 4 di N2O4 Reazioni all’equilibrio • In alcune reazioni i prodotti aumentano fino ad un certo livello e poi raggiungono concentrazioni stabili. • Analogamente un liquido in un recipiente chiuso evapora fino a raggiungere un equilibrio • L’equilibrio è dinamico: le reazioni continuano in entrambe le direzioni Sintesi dell’ammoniaca Soluzione satura • L’equilibrio è dinamico • Come nelle reazioni all’equilibrio, si verifica sia la reazione Diretta che quella Inversa, e quindi solo poco Prodotto finale sarà presente, ma in modo costante. • Soluz. Satura ha del Soluto indisciolto, che non ha reagito Le concentrazioni all’equilibrio • Per una reazione all’equilibrio (Es. esterificazione) le concentrazioni di reagenti e prodotti possono variare ma sono collegate da una relazione: la costante di equilibrio (Kc) (1864: Guldberg e Waage) Legge di azione di massa aA + bB = cC +dD • Kc e’ la costante di equilibrio (Keq) e relaziona le concentrazioni delle singole specie chimiche all’equilibrio • Le dimensioni di Kc variano con la stechiometria della reazione • Ogni reazione possiede una costante di equilibrio caratteristica, il cui valore dipende solo dalla temperatura. L’ Equilibrio chimico N2O4 2NO2 N 2O4 K eq 2 NO2 N2 +3H2 2NH3 NH 3 K eq 3 N 2 H 2 2 Costanti di equilibrio Hanno valori molto diversi: da 10-20 a 1030 Indicano la direzione della reazione E’ bene notare che le concentrazioni molari nell’espressione della Keq sono quelle all’equilibrio, e non quelle iniziali. CALCOLO della Kc Esempio: H2 (g) + I2 (g) 2 HI (g) H2 (g) I2 (g) HI (g) Concentrazioni iniziali 0.0175 0.0175 0 Variazioni delle concentrazioni nel raggiungimento dell’equilibrio -0.0138 -0.0138 +0.0276 Concentrazioni all’equilibrio 0.0037 0.0037 0.0276 [ HI]2 (0.0276)2 = = [H2][I2] (0.0037)(0.0037) 56 Equilibri chimici e formazione dei reagenti o dei prodotti • Se le moli dei reagenti sono uguali a quelle dei prodotti allora Kc è un numero puro • Se Kc >1 sono favoriti i prodotti • Se Kc >103 reazione procede a termine • Se Kc <1 sono favoriti i reagenti Relazioni tra le costanti di equilibrio Quoziente della reazione, Qc, pone in relazione le Concentrazioni delle specie chimiche, non all’equilibrio, con la Kc Se Qc >Kc si formano i Reagenti Se Qc = Kc si ha l’Equilibrio Se Qc< Kc si formano i Prodotti Kc e velocità • In un equilibrio dinamico le velocità di andata e di ritorno sono uguali • Il rapporto tra le due costanti cinetiche dà la costante di equilibrio, per la relazione diretta tra velocità e concentrazioni di reagenti e prodotti All’Equilibrio: (Kc) Costante di equilibrio e pressioni parziali •Nelle reazioni in fase gassosa le concentrazioni possono essere espresse in termini di pressione parziale •Concentrazione molare e Pressione parziale sono prorzionali secondo la legge dei Gas ideali •Da cui la costante di equilibrio può essere espressa in termini di pressioni parziali: Kp Equilibrio in fase gassosa. Kp 2NO2 NO2 N2O4 nNO2 N 2O4 K eq 2 NO2 PNO2 V RT nN2O4 PN2O4 N 2O4 V RT Kp PN2O4 PNO 2 2 Kp esprime l’equilibrio chimico in funzione delle pressione parziali dei vari componenti del sistema Confronto tra Kp e Keq aA +bB cC + dD C D K eq a b A B c K p Keq ( RT ) Se Dn = 0 d c d a b Kp = Kc Equilibri eterogenei Se almeno una delle specie chimiche che partecipano alla reazione si trova in una fase diversa si hanno equilibri eterogenei Es.: • Pressione di vapore tra gas e liquido • Solubilità Liquido-Solido o Liquido-Gas • Decomposizione del carbonato di calcio: CaCO3(s) e CaO(s) sono costanti Quindi, si sviluppa CO2 A 800°C PCO2 = 0,22atm Kp = 0,22 = Kc Equilibrio eterogeneo CaCO3 solido CaO +CO2 solido gas CO2 CaO K eq CaCO3 K p PCO 2 Keq CO2 Calcoli sull'equilibrio chimico La costante di equilibrio ci permette di prevedere: • la composizione di una miscela all'equilibrio per qualsiasi composizione di partenza. • il modo in cui cambia la composizione al cambiare delle condizioni (pressione, temperatura e proporzioni in cui sono presenti i reagenti). Condizioni Iniziali definite Nella decomposizione di una sostanza (HI) [H2] = [I2] = x Se C è la conc. Iniziale di HI, all’equilibrio [HI] = C – 2x Nota la Kc Kc = x2 / (C-2x)2 Kc = 0.022 (a 783 K) Equilibrio in fase gassosa Esercizi Calcolare la composizione della miscela che si forma all’equilibrio quando HI puro, 2.1mM, è aggiunto ad un contenitore e riscaldato alla temperatura di 490°C, alla quale Kc= 0.022 2HI H2 + I2 Kc = [H2][I2]/[HI]2 =0.022 •Kc =XxX/(C-2X)2 = (X/C-2X)2 • Kc = X / C-2X Moltiplico x C-2X • Kc(C-2X) = X •(1+2 Kc)X = C Kc •X= C Kc / 1+2 Kc Kc = = 0.022 = 0.15 X = 2.1 mM x 0.15/ 1+0.3 = 0.24 mM ALL’ EQUILIBRIO: H2 = 0.24mM I2 = 0.24mM HI = 2.1 mM – 0.48 mM = 1.6 mM Equilibrio in fase gassosa Esercizi 1) Una miscela di iodio e idrogeno è scaldata a 490°C. Le concentrazioni all’equilibrio sono [I2] = 3.1 mM e [HI] = 2.7 mM. Calcolare la concentrazione all’equilibrio di H2, sapendo che, a questa T, Kc = 46 per la reazione: H2 + I2 2HI Kc = [HI]2/[H2][I2]=46 [H2] = [HI]2/ [I2] x Kc = ((2.7 x10-3)2/[(3.1 x 10-3) • 46 ) [H2] =0.051 x 10 -3 Reagenti presenti in proporzioni stechiometriche Se nelle condizioni iniziali [N2] = [O2] = C e x è la diminuzione all’equilibro Allora la costante è: Kc=1.0 x 10-6 a 1000°C Condizioni iniziali arbitrarie Se le conc. iniziali di ossigeno e azoto sono diverse la relazione è più complessa Semplificazione per approssimazione Se prevediamo che si formi poco prodotto (x < 5% C) Allora, se x << C o C’: (C-x) ~ C (C’-3x) ~ C’ Equazioni di secondo grado nei calcoli di equilibrio chimico Come si risolve un’equazione di secondo grado. ax2 + bx + c = 0 x = [-b (b2-4ac)1/2]/2a Solo una delle due soluzioni possibili avrà significato fisico. Per esempio, una concentrazione non può mai essere negativa. Quindi una x che dà luogo ad una concentrazione negativa deve essere scartata. Notare però che x di per sé rappresenta una variazione di concentrazione e quindi può avere entrambi i segni. Il principio di Le Chatelier • Sia data una miscela di reazione all’equilibrio. • I parametri che determinano la condizione di equilibrio sono T, P e le concentrazioni delle varie specie. • Quando si cambia uno di questi parametri, il sistema evolverà per raggiungere un nuovo stato di equilibrio che si oppone alla modifica apportata. Variazione delle condizioni Principio di Le Chatelier: • Un equilibrio dinamico tende ad opporsi ad ogni cambiamento minimizzando l’effetto della perturbazione. Variazioni di – Temperatura – Concentrazione – Pressione Principio di Le Chatelier e posizione dell’equilibrio •Una variazione in P o nelle Concentrazioni provocherà una variazione nelle concentrazioni all’equilibrio. •L’effetto della variazione di T sulla posizione dell’equilibrio si comprende sapendo se una reazione è esotermica o endotermica. Effetto dell’aggiunta di un reagente Kc = [C]c[D]d/[A]a[B]b • Se si aumenta la concentrazione di un reagente la reazione procederà verso destra fino a ristabilire concentrazioni tali da soddisfare la Kc. • Effetto opposto se si introduce un prodotto nella miscela di reazione. Effetto dell’aggiunta di reagenti • All’aggiunta di estere o acqua • All’aggiunta di acido o alcol •Kc è indipendente da variazioni delle singole concentrazioni •Prima e dopo aggiunta di reagente le condizioni devono soddisfare l’equilibrio Principio di Le Chatelier • Modificazione della concentrazione di un reagente o di un prodotto Consideriamo la generica reazione : A + B C partendo con 20A e 20B si perviene all’equilibrio: 10 A + 10 B [C] K= _______ 10 C [10] __________ = = 0.1 [A] [B] [10] [10] •Immaginiamo di aggiungere 5 C alla miscela in equilibrio 10 A + 10 B 10 C •Quello che accade è che delle 5 moli di C, 2 vengono convertite in 2 A e 2B generando il nuovo equilibrio: 12 A + 12 B 13 C [13] K= __________ [12] [12] 0.1 I2 + H2 2 HI Partendo dal sistema all’equilibrio: Se aggiungiamo un extra quantità di I2 il sistema reagirà aggiustando le concentrazioni delle specie chimiche ristabilendo un nuovo equilibrio con la stessa Keq - H2 + I2 I2 + H 2 Se rimuoviamo un po’ di H2 ,di nuovo, il sistema reagirà aggiustando le concentrazioni delle specie chimiche ristabilendo un nuovo equilibrio con la stessa Keq 2 HI I2 + H2 2 HI Esempio : trasporto dell’O2 nel sangue equilibrio Ossiemoglobina Il trasporto dell’ossigeno da parte dell’emoglobina è un esempio di adattamento continuo dell’equilibrio alle differenti condizioni tissutali •Nei polmoni vi è abbondanza di ossigeno quindi: L’equilibrio è spostato a destra e l’ossigeno è legato all’emoglobina • Poi, il sangue raggiunge le cellule, dove vi è carenza di ossigeno: L’equilibrio si sposta a sinistra, e l’ossigeno viene rilasciato dall’ossiemoglobina Effetto della pressione • PCl5(g) PCl3(g) + Cl2(g) • Se si aumenta la P, la miscela all’equilibrio cambia composizione e diminuisce il numero totale di molecole allo stato gassoso presenti nel recipiente. • Per questa reazione quindi l’equilibrio si sposta a sinistra. • Non c’è effetto della P se non c’è variazione nel numero di molecole durante la reazione. Effetto pressione Un aumento della pressione fa diminuire il n. di molecole di gas • La velocità di sintesi è di 2° ordine, proporzionale a p2, e più sensibile alla concentrazione • In un gas l’aumento della pressione e’ accompagnato dalla diminuzione del volume e aumento della concentrazione. Effetto della temperatura Un equilibrio risponde a un aumento di temperatura assorbendo calore A+B C+D+Q Reazione esotermica Dipendenza dell’equilibrio dalla temperatura •Se la reazione è endotermica un aumento della temperatura sposta a destra (verso i prodotti) l’equilibrio e la Keq aumenta. •Se una reazione è esotermica un aumento della temperatura sposta a sinistra (verso i reagenti) l’equilibrio e la Keq diminuisce. Tale comportamento comune alla maggior parte delle reazioni può essere spiegato immaginando il calore come una reagente. + cal Reazione A + cal B A + cal B endotermica A B + cal Reazione esotermica A + cal B + cal Aspetti quantitativi La costante di equilibrio puo’ variare in modo sostanziale il funzione della temperatura per variazione della velocità della reazione diretta ed inversa N2 + 3 H2 2NH3 Reaz. Esotermica Kc=6.8x105 a 25 °C Kc=40 a 400 °C N2 + O2 2NO Reaz. Endotermica Kc=10-30 a 25 °C Kc=10-1 a 2000 °C Processore chimico catalico industriale x alte P e T favorisce le reazioni di sintesi - Haber-Bosh Conclusioni • L’equilibrio chimico è dinamico • La costante di equilibrio definisce i rapporti tra le concentrazioni (o pressioni) dei reagenti e prodotti all’equilibrio. Il suo valore indica la direzione della reazione. • Dipende dalla reazione, pressione e temperatura. • I calcoli permettono di stabilire la variazione dalle condizioni iniziali.
Scaricare