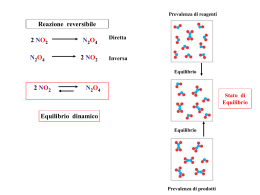
EQUILIBRIO CHIMICO SILSIS – VIII ciclo Paola Morandi CLASSE 2° I.T.C.S. con indirizzo biologico (biennio comune + triennio di indirizzo) Quadro orario del biennio: Chimica/SN Laboratorio 1° anno 2° anno 4 2 4 2 EQUILIBRIO CHIMICO: UN ESEMPIO Spesso le reazioni chimiche non sono complete: una parte dei reagenti è presente anche al termine della reazione Un esempio di equilibrio in fase gassosa: N2O4/NO2 N2O4 2 NO2 NB: NO2 è un gas tossico di colore rossastro; esiste anche nella forma dimerica incolore N2O4 COSA SIGNIFICA EQUILIBRIO CHIMICO ? Pressione parziale, atm NO2 N2O4 Tempo, sec Per qualsiasi concentrazione iniziale di NO2 e/o N2O4, la reazione NO2 N2O4 raggiunge una condizione di equilibrio La condizione di equilibrio è quella in cui le concentrazioni (ovvero le pressioni parziali) delle specie chimiche presenti rimangono costanti nel tempo Perché? una parte di N2O4 continua a trasformarsi in NO2 e viceversa: v1 N2O4 v2 2 NO2 ma all’equilibrio le velocità delle due reazioni sono uguali: v1 = v2 Quindi le proprietà macroscopiche del sistema restano costanti, ma i processi microscopici continuano bilanciandosi Sulla base di misure sperimentali è stato possibile definire un nuovo parametro: la costante di equilibrio (1864) Esp. P0 (atm) NO2 P0 (atm) N2O4 Peq (atm) NO2 Peq (atm) N2O4 Peq NO2 Peq N2O4 (Peq NO2)2 Peq N2O4 1 0.0 1.0 1.56 0.22 ~7 11 2 1.0 0.0 0.86 0.07 ~ 12 11 3 1.0 1.0 2.16 0.42 ~5 11 costante di equilibrio Keq Per la reazione N2O4 il rapporto (P NO2)2eq P N2O4 eq 2 NO2 è costante in un sistema chiuso, ad una certa T tale rapporto viene definito “costante di equilibrio Keq” Ricordiamoci che.... • • • Sistema isolato: non può scambiare né energia né materia con l’ambiente Sistema chiuso: può scambiare energia ma non può scambiare materia con l’ambiente Sistema aperto: può scambiare sia energia che materia con l’ambiente Quindi in un sistema chiuso la massa complessiva di reagenti e prodotti rimane costante A mano a mano che la reazione procede non vi sono perdite di prodotti o aggiunte di reagenti Come già osservato per la reazione N2O4 2 NO2 l’equilibrio viene raggiunto sia partendo dai reagenti che dai prodotti ! H2(g) + I2(g) diretta inversa 2 HI(g) 440°C Reazione diretta • inizio: [H2] = [I2] e [HI] = 0 Concentrazione • man mano che la reazione procede: [H2] e [I2] e [HI] (v1 ) • fino a quando [H2], [I2] e [HI] raggiungono un valore costante HI H2, I2 0 0 Tempo Tempo v1 = v 2 equilibrio Reazione inversa • inizio: ho solo [HI] • man mano che la reazione procede: [HI] e [H2] e [I2] (v2) • fino a quando [H2], [I2] e [HI] raggiungono un valore costante LA COSTANTE DI EQUILIBRIO è il rapporto tra le pressioni parziali/concentrazioni dei prodotti, ciascuna elevata ad una potenza pari al proprio coefficiente stechiometrico, e le pressioni parziali/concentrazioni dei reagenti, elevate ad una potenza uguale al proprio coefficiente stechiometrico. Consideriamo una generica reazione chimica in fase gassosa: aA + bB cC + dD KP = (PC)ceq (PD)deq (PA )a eq (PB )b gas eq Le pressioni parziali P sono proporzionali alle concentrazioni molari: PV = nRT KC = da cui P = (n/V) RT [C]ceq [D]deq [A]aeq [B]beq reazioni in soluzione cioè P = [M] RT con KP = KC (RT)n n = (c+d) – (a+b) per n = 0 KP = KC Keq dipende soltanto dalla temperatura Tutte le reazioni chimiche raggiungono l’equilibrio? In alcune reazioni le concentrazioni dei reagenti che rimangono quando il sistema raggiunge l’equilibrio sono troppo piccole per essere misurate. In questo caso si dice che la reazione è andata a completezza. Esempio: H2(g) + Cl2(g) 2 HCl(g) In alcune reazioni le concentrazioni dei reagenti e dei prodotti all’equilibrio sono misurabili (reazioni reversibili). Esempio: H2(g) + I2(g) 2 HI(g) La Keq permette di prevedere quanto una reazione chimica procede verso la completezza (più grande è la Keq, più la reazione è “spostata a destra”). In generale: Keq 1 favorita la formazione dei prodotti Keq 1 favoriti i reagenti NB La Keq non dà informazioni sulla velocità di reazione ! EQUILIBRIO DINAMICO L’equilibrio raggiunto dal sistema non è una condizione statica ma dinamica: le reazioni diretta e inversa continuano ad avvenire bilanciandosi. L’equilibrio si stabilisce quando le velocità della reazione diretta e inversa sono uguali ! aA + bB vd vi cC + dD all’equilibrio: Reazione diretta vdir = kdir [A]x [B]y Reazione inversa vinv = kinv [C]m [D]n All’equilibrio: KC = vd = vi kdir [A]x [B]y = kinv [C]m [D]n [C]ceq [D]deq [A]aeq [B]beq = kdir kinv kdir, inv = f(T) Keq = f(T) RIASSUMENDO… L’equilibrio chimico è la condizione in cui le concentrazioni di tutte le specie chimiche presenti in un sistema sono costanti nel tempo Ogni reazione chimica, in un sistema chiuso, raggiunge nel tempo una condizione di equilibrio che può essere più o meno spostato verso i prodotti di reazione Ogni reazione chimica all’equilibrio è caratterizzata da una costante di equilibrio, dipendente da T Per una generica reazione: aA + bB + … nN KC = cC + dD + … xX [C]ceq [D]deq … [X]xeq [A]aeq [B]beq … [N]neq Naturalmente: Keq (reazione diretta) = Unità di misura : mol/l È adimensionale se nr molireagenti = nr moliprodotti 1 Keq (reazione inversa) IL QUOZIENTE DI REAZIONE • • Si può usare la keq per prevedere in quale direzione procederà una reazione per ogni data concentrazione iniziale, cioè non di equilibrio, di reagenti e prodotti Definiamo Q = quoziente di reazione aA + bB cC + dD Q= [C]ciniziale [D]diniziale [A]ainiziale [B]biniziale In breve, se sono note le concentrazioni iniziali di reagenti e prodotti, si può prevedere la direzione in cui procederà la reazione nel modo seguente: per Q Keq la reazione procederà verso i prodotti fino a raggiungere l’equilibrio per Q Keq la reazione procederà verso i reagenti fino all’equilibrio per Q = Keq la reazione è già all’equilibrio EQUILIBRIO E TERMODINAMICA Esiste una relazione tra Keq ed energia libera di Gibbs G. Ricordiamo che: G = Gprodotti – Greagenti G indica la spontaneità di un processo chimico G 0 G 0 G = 0 Keq 1 Keq 1 Keq = 1 equilibrio spostato verso i reagenti equilibrio spostato verso i prodotti non sono favoriti né i prodotti né i reagenti all’eq. G = -RTlnKeq È quindi possibile calcolare la Keq di una reazione in condizioni standard (25°C, 1 atm) dal valore di energia libera standard di reagenti e prodotti. ESERCIZIO In un recipiente da 1 l si introducono 2 moli di H2 e 1 mole di I2 a 440°C e si ha la reazione H2 + I2 2 HI (NB I2 è solido a 25°C). Calcolare la concentrazione delle specie all’equilibrio, sapendo che Kc = 50 a 440°C. H2 Inizio + I2 2 HI 2 1 / Variazione -x -x 2x Equilibrio 2-x 1-x 2x KC = (2x)2 (1-x) (2-x) = 50 [HI]eq = 2x = 1.870 M da cui x = 0.935, perciò: [H2]eq = 2-x = 1.065 M [I2]eq = 1-x = 0.065 M PRINCIPIO DI Le Chatelier Un sistema che si trova in condizioni di equilibrio reagisce ad una perturbazione esterna in modo da ripristinare l’equilibrio L’equilibrio può essere perturbato dalla variazione di: • • • Concentrazione delle specie chimiche presenti Temperatura Pressione (nel caso di specie chimiche allo stato gassoso) Ricordiamoci che la Keq è una costante che dipende soltanto dalla T NB L’equilibrio non viene influenzato dalla presenza di un catalizzatore Un catalizzatore è un composto in grado di aumentare la velocità con cui è raggiunto l’equilibrio chimico, senza modificarne la posizione VARIAZIONE DI CONCENTRAZIONE Se in un sistema all’equilibrio si varia la concentrazione di una delle specie presenti, l’equilibrio si sposta in modo da compensare la variazione di concentrazione. Supponiamo che la seguente reazione sia all’equilibrio: aA + bB cC + dD KC = [C]ceq [D]deq [A]aeq [B]beq Si aggiunge A o B: l’equilibrio si sposta a dx in modo da consumare una maggiore quantità di reagenti aA + bB cC + dD Si allontana C o D: l’equilibrio si sposta a dx per ripristinare il prodotto allontanato aA + bB cC + dD Se si aggiunge un prodotto o si allontana un reagente, l’equilibrio si sposta a sinistra ESEMPI 1. Consideriamo la seguente reazione: H2 + I2 2 HI 2. Consideriamo la seguente reazione: CaCO3(s) aggiunta di H2 aggiunta di HI allontanamento di I2 allontanamento di HI spostamento a dx spostamento a sin spostamento a sin spostamento a dx CaO(s) + CO2(g) Operando in un recipiente aperto la CO2 si allontana man mano che viene prodotta: ciò comporta lo spostamento dell’equilibrio verso destra (con conseguente dissolvimento del carbonato di calcio) Quando si elimina un prodotto, si può far arrivare a completezza una reazione che altrimenti andrebbe all’equilibrio ! VARIAZIONE DI PRESSIONE Se in un sistema all’equilibrio in cui siano presenti uno o più gas si ha una variazione di pressione, allora le pressioni parziali (e quindi le concentrazioni) dei gas reagenti cambiano in corrispondenza. In particolare, ciò si verifica nel caso di reazioni in cui tra reagenti e prodotti varia il numero di moli allo stato gassoso, e quindi la pressione. RICORDIAMOCI: 1) Legge dei gas ideali 2) Legge di Dalton delle pressioni parziali Consideriamo l’equilibrio: PV=nRT Ptotale = p1 + p2 … + pn 2 A(g) + B(g) C(g) + 4 D(g) P eq In questo caso la reazione verso dx implica un aumento del numero di moli totali (da 3 a 5) e quindi di P L’aumento di P fa spostare l’equilibrio verso sinistra ESEMPI (1) 1. Consideriamo la seguente reazione: 2 CO(g) + O2(g) 2 CO2(g) La trasformazione dei reagenti nei prodotti comporta una diminuzione del numero di moli (da 3 a 2), quindi: - Se P allora spostamento a dx - Se P allora spostamento a sin 2.Consideriamo la seguente reazione: H2O(g) + CO(g) H2(g) + CO2(g) La reazione non comporta variazione del numero di moli tra reagenti e prodotti. In questo caso una perturbazione della pressione non comporta effetti sull’equilibrio ESEMPI (2) NH3 Consideriamo la reazione: N2 N2(g) + 3 H2(g) 2 NH3(g) H2 Pi 2 Pi V/2 V Pf 2 Pi V/2 N2 + 3 H2 2 NH3 N2 + 3 H2 2 NH3 N2 + 3 H2 2 NH3 Equilibrio Non equilibrio Equilibrio ristabilito Quando il volume viene dimezzato, l’equilibrio si sposta a destra diminuisce il numero totale di molecole e quindi la pressione totale VARIAZIONE DI TEMPERATURA Una variazione della temperatura influenza la posizione di un equilibrio perché cambia il valore della costante di equilibrio. Anche senza conoscere il valore della Keq alle diverse T, è possibile prevedere come si sposta l’equilibrio in conseguenza ad una variazione di T. Per fare questa previsione devo sapere se la reazione è esotermica o endotermica: Reazione esotermica, H 0 Reazione endotermica, H 0 aA + bB cC + dD + calore aA + bB + calore cC + dD Il calore ceduto o assorbito può essere indicato nel simbolo di reazione insieme a reagenti e prodotti. Es: nel caso di una reazione esotermica, un aumento di T provoca lo spostamento dell’equilibrio a sinistra; Keq diminuisce. Processi esotermici: favoriti da una diminuzione di T (Keq aumenta) Processi endotermici: favoriti da un aumento di T (Keq aumenta) ESEMPI (1) Consideriamo la seguente reazione esotermica: 2 NO2(g) N2O4(g) + calore rosso 25°C incolore raffreddo equilibrio 25°C scaldo equilibrio ESEMPI (2) Consideriamo la seguente reazione esotermica: H2(g) + I2(g) 2 HI(g) + calore Se diminuisce la T, l’equilibrio idrogeno-iodio si sposta verso destra: il calore così prodotto tende ad aumentare la T, contrapponendosi alla diminuzione iniziale di T. Il contrario per una diminuzione iniziale di T. Si può arrivare alla stessa conclusione se si conoscono i valori delle Keq alle due T. In questo caso ho che: KC = [HI]2 KC = 67.5 a 325°C [H2] [I2] KC = 50.0 a 450°C La resa di HI diminuisce con l’aumento di T RIASSUMENDO… VARIAZIONI DI CONCENTRAZIONE PERTURBAZIONE EFFETTO Aumento di un reagente o diminuzione di un prodotto Spostamento a destra PERTURBAZIONE EFFETTO Diminuzione di un reagente o aumento di un prodotto Spostamento a sinistra VARIAZIONI DI TEMPERATURA REAZIONE ESOTERMICA PERTURBAZIONE ed EFFETTO PERTURBAZIONE ed EFFETTO Aumento di T, spostamento a sin Diminuzione di T, spostamento a dx REAZIONE ENDOTERMICA PERTURBAZIONE ed EFFETTO PERTURBAZIONE ed EFFETTO Aumento di T, spostamento a dx Diminuzione di T, spostamento a sin VARIAZIONI DI PRESSIONE Moli reagenti moli prodotti PERTURBAZIONE ed EFFETTO Aumento di P, spostamento a dx PERTURBAZIONE ed EFFETTO Diminuzione di P, spostamento a sin Moli reagenti moli prodotti PERTURBAZIONE ed EFFETTO Aumento di P, spostamento a sin PERTURBAZIONE ed EFFETTO Diminuzione di P, spostamento a dx Moli reagenti = moli prodotti PERTURBAZIONE ed EFFETTO Aumento o diminuzione di P, nessun effetto Tutte le specie chimiche solide, liquide o sciolte in soluzione PERTURBAZIONE ed EFFETTO Aumento o diminuzione di P, nessun effetto EQUILIBRI ETEROGENEI • Sono gli equilibri in cui le sostanze coinvolte non sono tutte nello stesso stato di aggregazione (fasi gassose con fasi condensate) • In questi sistemi la posizione dell’equilibrio è indipendente dalla concentrazione di liquido o di solido presente, perché tale concentrazione è costante nel corso della reazione* • Pertanto le concentrazioni delle specie condensate non compaiono nell’espressione della Keq • Solo le specie in fase gassosa determinano l’equilibrio * [ ] è mol/l PM è g/mol [ ] PM = densità g/l la densità di un solido puro è costante, indipendentemente dalla quantità presente UN ESEMPIO DI EQUILIBRIO ETEROGENEO CaCO3(s) CaO(s) + CO2(g) Kc = [CaO]eq [CO2]eq [CaCO3]eq Quindi Kc = [CO2]eq o in termini di pressioni parziali: Kp = (p CO2)eq Kp CO2 = 1.04 atm a 900°C CO2(g) 25°C CO2(g) CaCO3 CaCO3 CaO CaCO3(s) 900°C 1.04 atm CaO(s) + CO2(g) equilibrio 900°C CaO CaCO3(s) CaO(s) + CO2(g) l’equilibrio non si raggiunge la reazione va a completezza EQUILIBRI IONICI IN SOLUZIONE Gli equilibri che si stabiliscono tra ioni in soluzione acquosa vengono interpretati secondo le leggi generali che regolano gli equilibri chimici. Verranno considerati due tipi di equilibri ionici: 1. L’equilibrio esistente tra un solido indisciolto e le sue specie disciolte (eq. di solubilità) 2. L’equilibrio che si stabilisce tra una specie indissociata ed i suoi ioni dissociati (eq. di dissociazione), che spesso riguarda ACIDI e BASI Ricordiamo che: ELETTROLITA = sostanza che in soluzione si dissocia totalmente o parzialmente in ioni (cationi + e anioni -). Si distinguono: - Elettrolita forte, completamente dissociato (sali, alcuni acidi e basi) - Elettrolita debole, parzialmente dissociato (solo acidi e basi) Grado di dissociazione α = rapporto tra nr di molecole dissociate e nr totale di molecole EQUILIBRI DI SOLUBILITÀ: INTRODUZIONE H2O + solido poco solubile soluzione SATURA: gli ioni di sale disciolto sono in equilibrio con il soluto non sciolto Esempio: AgCl(s) Ag+ (aq) + Cl- (aq) KC = [Ag+] [Cl-] [AgCl(s)] ma [AgCl(s)] è costante (vedi eq. eterogenei), quindi [Ag+] [Cl-] = KC [AgCl] = Kps Kps = prodotto di solubilità è una costante che dipende da T Per un generico composto ionico: AmBn(s) mA(aq) + nB(aq) Kps = [A]meq [B]neq Conoscendo il valore di Kps si può prevedere se in una soluzione si ha o meno precipitazione in determinate condizioni. ACIDI E BASI: INTRODUZIONE Nel corso dei secoli gli ACIDI e le BASI sono state definiti in vari modi, e ogni nuova definizione ha cercato di comprendere un numero progressivamente maggiore di casi. 1. Arrhenius Acido = sostanza che in H2O si dissocia in ioni H+ e X- Es. HCl H+ + Cl- Base = sostanza che in H2O si dissocia in ioni M+ e OH- Es. NaOH Na + OH- 2. Brönsted-Lowry Acido = sostanza in grado di cedere protoni Es. HCl H+ + Cl- Base = sostanza in grado di accettare protoni Es. NH3+H2O NH4+ +OH- Alcune sostanze possono sia cedere che accettare protoni (anfoteri). L’acqua è un anfotero dell’acqua) (lo scambio può avvenire anche tra due molecole di acqua: H2O + H2O H3O+ + OH- autoprotolisi 3. Lewis Acido = accettore di una coppia di elettroni (elettrofilo) Base = donatore di una coppia di elettroni (nucleofilo) La reazione tra un acido di Lewis e una base di Lewis porta alla formazione di un legame covalente DATIVO Es: F H F-B + N-H F acido H base F H F-BN-H F H FORZA DEGLI ACIDI E DELLE BASI Un generico acido HA si dissocia in H2O secondo la reazione: HA + H2O H3O+ + AKC = [H3O+]eq [A-]eq [HA]eq = Ka costante di dissociazione acida Acido FORTE molto dissociato alti valori di Ka Acido DEBOLE poco dissociato bassi valori di Ka NB gli acidi POLIPROTICI possono dare la dissociazione di più protoni H+; generalmente le Ka sono progressivamente più piccole negli stadi successivi al primo (es. H3PO4). Stesso discorso vale per le basi ! ESPERIENZE DI LABORATORIO Modifiche dell’equilibrio chimico Prima esperienza: spostamento dell’equilibrio al variare di T Obiettivo: l’esperienza permette di osservare uno degli esempi di equilibrio chimico illustrati nel corso della lezione. In particolare, si verificherà come un equilibrio in fase gassosa venga influenzato dal variare della temperatura. Note sicurezza: gli acidi utilizzati provocano gravi ustioni per contatto ed i loro vapori sono nocivi. I gas prodotti nel corso della reazione sono forti irritanti delle vie polmonari. Il solfato di rame è tossico. Tutte le operazioni richiedono l’uso di camice, guanti e occhiali. Evitare l’ingestione di soluzioni o solidi. Evitare di respirare i vapori degli acidi e i gas prodotti nel corso della sperimentazione (LAVORARE SOTTO CAPPA). In caso di contatto della pelle o degli occhi con gli acidi lavarsi abbondantemente con acqua corrente. Ricordarsi di aggiungere gli acidi all’acqua e mai viceversa (l’idratazione di alcuni acidi quali l’acido solforico è fortemente esotermica), lentamente e senza produrre schizzi. Lavare bene tutto il materiale utilizzato e il banco di lavoro al termine dell’esperimento. Premessa: per portare in soluzione un metallo (ed ottenere i suoi composti) bisogna ossidarlo. Lo ione H3O+ è in grado di ossidare la maggior parte dei metalli, ma non il rame (e tutti i metalli detti “nobili”). Per ossidare il rame è necessario utilizzare acidi che siano forti ossidanti, quali l’acido solforico concentrato o l’acido nitrico. Il rame metallico, in presenza di questi acidi, reagisce secondo la reazione: 3 Cu(s) + 2 HNO3 + 3 H2SO4 3 CuSO4 + 2 NO(g) + 4 H2O NO(g) si ossida all’aria per dare biossido di azoto NO2(g) . Materiali occorrenti: trucioli di rame – acido nitrico sol. 65% - acido solforico conc. – ghiaccio - vetreria. Esecuzione dell’esperienza: 1. Porre dei trucioli di rame in una provetta e coprirli con circa 2 ml di acqua. 2. Sotto cappa aggiungere circa 2 ml di acido solforico conc., lentamente. 3. Sotto cappa aggiungere circa 2 ml di acido nitrico sol. 65% e chiudere velocemente la provetta con un tappo munito di tubo di sviluppo, raccogliendo il gas prodotto in un palloncino. Infine chiudere il palloncino con un tappo di gomma. Annotare il colore del gas prodotto. 4. Porre il palloncino in ghiaccio e lasciar raffreddare per almeno 15 minuti. Annotare il colore del gas. 5. Lasciar riscaldare il palloncino alla T ambiente (per es. tenere il palloncino tra le mani) e annotare il colore del gas. Seconda esperienza: spostamento dell’equilibrio al variare delle concentrazioni Obiettivo: l’esperienza è un esempio di equilibrio ionico in soluzione. Essa permette di osservare come varia l’equilibrio cromato/bicromato in seguito al variare della concentrazione delle specie chimiche coinvolte in tale equilibrio. Inoltre, la precipitazione di una delle specie chimiche coinvolte consente di ragionare sull’equilibrio in fase eterogenea. Note sicurezza: i composti del cromo(VI) sono molto tossici se ingeriti. Anche se le quantità utilizzate in questo esperimento sono modeste, evitare assolutamente di ingerire le soluzioni. Evitare il contatto della pelle e degli occhi con tutti i reagenti utilizzati e nel caso di contatto lavarsi abbondantemente con acqua corrente. Indossare camice, guanti e occhiali. Lavare con sapone le mani al termine dell’esperimento. Lavare bene anche tutto il materiale utilizzato e il banco di lavoro. Premessa : una soluzione acquosa di cromato di potassio è gialla; una soluzione acquosa di bicromato di potassio è arancione. L’equilibrio che verrà preso in considerazione è il seguente: 2 CrO42-(aq) + 2 H+(aq) Cr2O72-(aq) + H2O L’aggiunta di nitrato di bario Ba(NO3)2 ad una soluzione contenente ioni cromato determina la precipitazione del cromato di bario BaCrO4. Materiali occorrenti: cromato di potassio sol. 0.1 M – bicromato di potassio sol. 0.1 M– acido cloridrico sol. 1 M – idrossido di sodio sol. 1 M – nitrato di bario sol. 0.1 M – vetreria (tubi da 13 x 100 mm). Esecuzione dell’esperienza: Parte prima 1. 2. 3. 4. 5. In un tubo pulito versare ca. 1 ml (10 gocce) di CrO42- sol. 0.1 M. In un secondo tubo pulito versare ca. 1 ml di Cr2O72- sol. 0.1 M. Annotare il colore delle soluzioni. A ciascun tubo aggiungere goccia a goccia (massimo 5 gocce) 1 M HCl e annotare il colore selle soluzioni. Ripetere il punto 1 utilizzando due tubi puliti. Aggiungere a ciascun tubo, goccia a goccia (massimo 5 gocce) 1 M NaOH. Annotare il colore delle soluzioni. Aggiungere ai tubi del punto 2 (+ HCl) 1 M NaOH (massimo 10 gocce). Annotare il colore delle soluzioni. Aggiungere ai tubi del punto 3 (+ NaOH) 1 M HCl (massimo 10 gocce). Annotare il colore delle soluzioni. Parte seconda 1. 2. 3. 4. 5. In un tubo pulito versare ca. 1 ml (10 gocce) di 0.1 M CrO42- e aggiungere 2 gocce di 1 M NaOH; aggiungere goccia a goccia 0.1 M Ba(NO3)2 ed osservare cosa succede. In un tubo pulito versare ca. 1 ml di 0.1 M Cr2O72- e aggiungere 2 gocce di 1 M HCl; aggiungere goccia a goccia 0.1 M Ba(NO3)2 e osservare cosa succede. Aggiungere al tubo del punto 1 del 1 M HCl goccia a goccia e osservare. Aggiungere al tubo del punto 2 del 1 M NaOH goccia a goccia e osservare. Preparare due nuovi tubi: uno con ca. 1 ml di 0.1 M CrO42- e uno con 1 ml di 0.1 M Cr2O72-. Aggiungere ca. 5 gocce di 0.1 M Ba(NO3)2 e annotare cosa succede. Terza esperienza: spostamento dell’equilibrio al variare delle concentrazioni e di T Obiettivo: l’esperienza è un esempio di equilibrio ionico in soluzione. Permette di osservare come varia l’equilibrio tetraclorocobalto/esacquocobalto in seguito al variare della concentrazione di cloro e, inoltre, di valutare l’effetto della temperatura sull’equilibrio in esame. Infine tale esperienza consente un curioso richiamo alla vita di tutti i giorni. Note sicurezza: l’acido cloridrico al 37% provoca gravi ustioni per contatto ed i suoi vapori sono nocivi. Tutte le operazioni richiedono l’uso di camice, guanti e occhiali. Evitare l’ingestione di soluzioni. Evitare di respirare i vapori dell’acido (prelevare SOTTO CAPPA). In caso di contatto della pelle o degli occhi con l’acido lavarsi abbondantemente con acqua corrente. Ricordarsi di aggiungere l’acido all’acqua e mai viceversa. Lavare bene tutto il materiale utilizzato e il banco di lavoro al termine dell’esperimento. Premessa: lo ione Co2+ manifesta la tendenza a legarsi con specie chimiche ricche di elettroni (basi di Lewis) quali H2O e ioni Cl-, formando ioni complessi spesso colorati. L’equilibrio che verrà preso in considerazione è il seguente: [Co(H2O)6]2+ + 4 Cl- + calore [CoCl4]2- + 6 H2O Lo ione esacquocobalto è rosa e si forma sciogliendo CoCl2 in acqua ; lo ione tetraclorocobalto è blu. Ricordiamo inoltre che: AgNO3 + Cl- AgCl(s) + NO3- Materiali occorrenti: CoCl2 soluzione acquosa 0.4 M – HCl sol. 37% - AgNO3 soluzione acquosa 0.1 M – ghiaccio – piastra riscaldante – vetreria. Esecuzione dell’esperienza: 1. In una provetta versare circa 5 ml di 0.4 M CoCl2 (soluzione rosa) e aggiungere goccia a goccia HCl 37% (sotto cappa) fino a colorazione intermedia tra rosa e blu. 2. Dividere il contenuto in tre provette A, B e C (quest’ultima da usare come riferimento). 3. Immergere la provetta A in acqua bollente e la provetta B in acqua e ghiaccio. Annotare le variazioni di colore. 4. Ripetere il punto 1 e aggiungere 0.1 M AgNO3 osservando come varia il colore. CURIOSITÀ : il colore delle statuine segnatempo varia dall’azzurro (con il bel tempo) al rosa (quando volge al brutto e aumenta l’umidità nell’aria). La superficie di queste statuine è rivestita di un sale di Co2+. SCHEDA DI LABORATORIO Prima esperienza 1. Scrivere la reazione che descrive l’equilibrio in fase gassosa e spiegare le variazioni di colore del gas osservate 2. Spiegare come la temperatura influenza l’equilibrio chimico Seconda esperienza 1. Scrivere la reazione che descrive l’equilibrio cromato/dicromato 2. Spiegare la variazione di colore osservata in seguito all’aggiunta dell’acido o della base o di acido e base insieme 3. Spiegare in quale condizione si è osservata formazione di un precipitato e perché 4. Facendo riferimento alla formazione del precipitato, spiegare perché si ottengono risultati diversi in presenza o in assenza dell’acido o della base (quindi qual è l’effetto dell’acido o della base sulla reazione di precipitazione) Potete aiutarvi utilizzando la tabella alla pagina seguente Terza esperienza: 1. Scrivere la reazione che descrive l’equilibrio in esame 2. Spiegare la variazione di colore in seguito al variare della temperatura 3. Spiegare la variazione di colore dopo aggiunta di nitrato d’argento 4. Provare a spiegare come funzionano le statuine segnatempo Step Variazione introdotta 2 + 1 M HCl 3 + 1 M NaOH etc. 2 CrO42- + 2 H+ Cr2O72- + H2O cromato + HCl cromato bicromato + Ba(NO3)2 + HCl + HCl + Ba(NO3)2 + NaOH + NaOH bicromato + NaOH + NaOH + HCl cromato bicromato + Ba(NO3)2 2 CrO42- + 2 H+ Cr2O72- + H2O
Scaricare